注射剂是一类复杂制剂,一般基于脂质体、微球、脂肪乳、混悬液、油溶液、胶束等剂型的自身特性而获得靶向递送药物、缓控释等优势。特殊注射剂的研发难度大,通常应基于质量源于设计(QbD)理念进行相应的制剂开发。文章综述了特殊注射剂研发过程中关键质量属性(CQAs)识别和质量风险管理(QRM)应用的研究进展,期望为相关药品研发提供参考。
与普通注射剂相比,特殊注射剂的质量指标及其活性药物成分的体内行为受处方和工艺影响较大,可能会进一步影响药品的安全性和有效性。特殊注射剂一般基于脂质体、脂肪乳、微球、混悬液、油溶液、胶束等 [1] ;与普通注射剂相比,具有实现靶向功能、减少给药次数和延长产品生命周期等优点,因而其研发也更加复杂且具有挑战性。质量源于设计 (quality by design,QbD) 是一套系统的研发方法,即从预定的目标出发,基于科学管理和质量风险管理 (quality risk management,QRM),强调对产品与工艺的理解及工艺控制 [2]。基于 QbD理念,药物制剂产品开发的第一步是确定目标产品质量概况 (quality target product profile,QTPP)。根据 QTPP 进一步确定关键质量属性 (critical qualit yattributes,CQAs),并系统地研究各种处方和工艺因素对于 CQAs 的影响 [3]。本综述对目前部分特殊注射剂的 CQAs 和质量风险管理研究进行综述,旨在为相关研究提供参考。
Part.01
特殊注射剂的分类
1.1 微球
微球是指药物溶解或分散在载体辅料中形成的小球状实体,通常粒径为 1 ~ 250 μm[4]。目前常用的载体材料主要为可降解的聚乳酸 (PLA) 和聚乳酸 - 羟基乙酸共聚物 (PLGA)。微球的制备方法有溶剂挥发法、喷雾干燥法、相分离法、连续流技术等。微球化技术能够使药物具有缓控释性能、减轻或避免血药浓度峰谷现象,从而获得减轻不良反应、减少治疗周期内的给药剂量、提高药物的生物利用度与患者依从性等优势 [5]。目前,美国 FDA 批准上市的微球制剂 [6] 有日本武田制药公司的醋酸亮丙瑞林微球Lupron Depot®、瑞士 Novartis 公司的醋酸奥曲肽微球Sandostatin LAR®、美国Johnson和爱尔兰 Alkermes公司联合开发的利培酮微球 Risperdal Consta® 等。
1.2 脂质体
脂质体是一种由双层磷脂包裹的具有水相内核的微小囊泡,是将有效成分包封在类脂质双分子层内形成的微型球状载体 [7]。脂质体一般由磷脂和胆固醇构成。磷脂为两亲性物质,在形成脂质体时,2 条疏水链指向内部,亲水性基团停留在膜的内外2 个表面 ;磷脂双层构成的封闭小室可包封住亲水性药物的水溶液 ;而由磷脂双层形成的囊泡又被水相介质分开 [3]。脂质体可通过被动和主动方式载药。被动载药技术包括薄膜分散法、注入法、逆相蒸发法等 ;主动载药技术包括 pH 梯度法、硫酸铵梯度法和乙酸钙梯度法等。脂质体的结构类似于生物膜囊泡,可直接进入细胞,具有被动靶向、延长药物作用时间、减轻药物毒性的特点 [8]。目前全球范围内上市的脂质体制剂 [6] 有美国 ALZA 公司的多柔比星脂质体 Doxil®/Caelyx®、美国 Gilead 公司的两性霉素 B 脂质体 AmBisome®、中国绿叶制药公司的紫杉醇脂质体力扑素 ®、美国 Merrimack 公司的伊立替康脂质体 Onivyde® 等。
1.3 脂肪乳
脂肪乳又称为亚微乳,是指将药物溶于脂肪油、植物油中,经磷脂乳化分散于水相中,形成的粒径100 ~ 600 nm 的 O/W 型微粒分散体系 [3,9]。脂肪乳的主要辅料为甘油三酯和磷脂,通过高压均质法、相变温度法和相转变乳化法等方法制备。脂肪乳作为药物载体可以增加药物溶解度,具有缓控释、减小静脉给药的血管刺激性、减轻药物不良反应等优点。目前已经有德国 Sanofi-Aventis 公司的多西他赛注射液 TAXOTERE®、德国 B.Braun MelsungenAG 的依托咪酯中 / 长链脂肪乳注射液 EtomidateLipuro、日本田边三菱制药公司的前列腺素 E1 脂肪乳注射液 Liple® 和德国 Solupharm Pharmazeutische Erzeugnisse GmbH 的尼莫地平注射液 Nimotop® 等产品上市。
1.4 混悬型注射剂
混悬型注射剂是涉及难溶盐技术、前体药物技术、药物纳米晶技术和载药纳米粒技术等的一类复杂制剂。混悬型注射剂具有提高药物疗效、减轻不良反应、降低给药频率等优势 [10]。目前已上市的产品 [11] 包括帕利哌酮棕榈酸酯长效注射剂 ( 商品名 Invega Sustenna®)、双羟萘酸奥氮平注射液 ( 商品名 Zyprexa Relprev®) 等。
Part.02
特殊注射剂的 CQAs
CQAs 是指产品的物理、化学、生物或微生物性质或特征,应在适当的限度、范围或分布之内,以确保预期的产品质量。在特殊注射剂的研发阶段,应通过目标产品的质量特征和风险来源确定制剂的CQAs ;在后续的评价过程中,运用质量风险管理,再对 CQAs 进行优先排序 ;通过反复的质量风险评价,确定参数变化对药品质量的影响程度,可以最终确定相关的 CQAs,从而有效保证产品质量符合预期目标 [2]。本项将对微球、脂质体、脂肪乳和混悬型注射剂的 CQAs 研究情况进行综述。
2.1 微球的 CQAs
微球制剂可有效减少给药频次,在临床上具有明显的优势 [3]。但微球作为药物载体也存在药物突释、蛋白和多肽药物载药不稳定、灭菌要求严格等问题。因此通过试验确定微球的 CQAs 对于其质量控制十分重要。ZHANG 等 [12] 通过对艾塞那肽微球制剂 Bydureon® 进行分析,确定其 CQAs 包括鉴别、含量测定、含量均匀度、无菌和细菌内毒素、药物释放模式等,其中的药物释放模式被认定为高风险 CQA。药物释放模式与微球粒径、载药量、密度和药物分布有关。微球粒径大小主要影响药物突释量和控释阶段的释放行为,由于比表面积增加,小粒径微球相较于大粒径微球会表现出更显著的突释效应 [13—14]。而当微球载药量增加时,表面的药物装载量更多,与释放介质间的药物浓度梯度也更大,使得微球的突释效应增强 [15—16]。微球的密度通常可以调节药物的释放速度,密度越高,微球的降解速度越慢,药物在微球表面的分布会直接影响突释效应的强弱[17—18]。SU等[19]以PLGA微球为例,分析其 CQAs,如粒径和粒度分布、孔隙率、微球表面形态等。安广峰等 [20] 对曲安奈德微球、醋酸亮丙瑞林微球和醋酸奥曲肽微球进行分析,指出微球制剂的 CQAs 包括残留溶剂、有关物质、通针性、可见异物等。
2.2 脂质体的 CQAs
脂质体处方复杂,在产业化开发阶段,应以制剂的 CQAs 为基础,制定科学、合理、严谨的控制策略以获得质量稳定、均一的产品 [21]。FDA 在脂质体药物制剂研究的行业指南中指出,脂质体的形态、ζ 电位、黏度、药物包封率、载药量、粒径、体外释放、泄漏率等会导致其质量发生改变,不同脂质体的药物适用特性不同,可将这些物理化学性质作为 CQAs[22]。NÉMETH 等 [23] 对可作为脂质体CQAs 的质量属性进行收集,结果如表 1 所示。
表1 脂质体的 CQAs [23]
2.3 脂肪乳的 CQAs
静脉注射脂肪乳根据临床应用可分为两类,一类是载药型脂肪乳,可以用作药物递送载体 ;另一类是营养型脂肪乳,用于高危患者的肠外营养供给,不含活性药物成分,不具有治疗作用 [24]。营养型脂肪乳已有 50 多年的应用历史,而作为药物载体的研究近年来才日益增多。DENG 等 [25] 采用鱼骨图和风险矩阵图,对脂溶性维生素脂肪乳注射剂的质量属性进行了识别,确定含量、平均粒径、PDI、ζ 电位、5 μm 以上大粒子的体积分数 (volumeweighted percent of fat greater than five micrometers,PFAT5) 为 CQAs。脂肪乳的平均粒径和粒度分布与制剂的安全性和有效性密切相关。《中华人民共和国药典》2020 年版四部注射剂通则规定静脉用乳状液型注射液中 90%的乳滴粒径应在 1 μm 以下,不得有大于 5 μm 的乳滴。PDI 是代表脂肪乳粒度分布的另一重要指标,PDI<0.7 的脂肪乳才被认为可用于肠外营养 [26—27]。ζ 电位绝对值大于 30 mV可被认为处于稳定的状态 [27]。PFAT5 对于脂肪乳的安全性有重要影响,因为 5 μm 以上的大粒子可能导致毛细血管堵塞等严重后果,若 PFAT5 超过0.05%,还可能会对肺和肝脏产生毒性 [25]。董武军等 [28] 对载药脂肪乳的质量属性进行分析,确定将脂肪乳的平均粒径、PFAT5、包封率、相分布、体外释放、物理稳定性作为其 CQAs。
2.4 混悬型注射剂的 CQAs
药物制成混悬型注射剂后,大多具备长效释药的特点,可减少给药次数,因此目前在精神疾病治疗领域的应用较多 [11]。对于混悬型注射剂,主要关注的质量属性有外观、粒径及其分布、ζ 电位、pH 值、渗透压、晶型、体外释放等,可根据具体的药物制剂确定相应的 CQAs[29]。JOSHI 等 [30] 应用 QbD 理念对利福平白蛋白纳米粒进行研究,确定粒径、PDI、ζ 电位、包封率、体外释放作为其CQAs。适宜静脉注射的粒子粒径应小于 200 nm,且当 PDI 小于 0.5、ζ 电位绝对值大于 25 mV 时,才能得到有效、稳定的制剂 [31]。SHI 等 [32] 通过不同的结晶方法制备了帕利哌酮棕榈酸酯纳米混悬注射剂,发现采用不同的结晶方法制备得到的混悬剂粒径大小、分布以及结晶度有所不同,并且会进一步影响制剂在体内的稳定性和药代动力学性质。
Part.03
质量风险管理在特殊
注射剂研发中的应用
在药品研发过程中存在诸多不确定性,构建药品质量管理体系是保证药品质量的关键,质量风险管理是有效质量体系的重要组成部分 [3]。ICH Q9《质量风险管理》[33] 指出的 2 个主要原则是 :质量风险的评估应以科学知识为基础,并最终与患者保护相联系 ;质量风险管理过程的工作水平、形式和文件应与风险水平相适应。为了让特殊注射剂的研发达到预期目标,在药品研发前就要树立风险管理的观念,主要是利用专门的分析评估技术,对研发管理中有关环节存在风险的可能性进行科学、合理、安全地分析和评估,从而有效规避研发风险,提高药品质量。
3.1 质量风险管理的一般流程
质量风险管理是对药品在产品生命周期中的质量风险进行评估、控制、沟通和审查的系统过程,一般流程如图 1 所示 [33]。初始的风险评估对于使产品的质量风险最小化非常重要,它包括对风险的识别、分析和评估。运用科学、合理的工具和方法能够使得这个过程事半功倍。
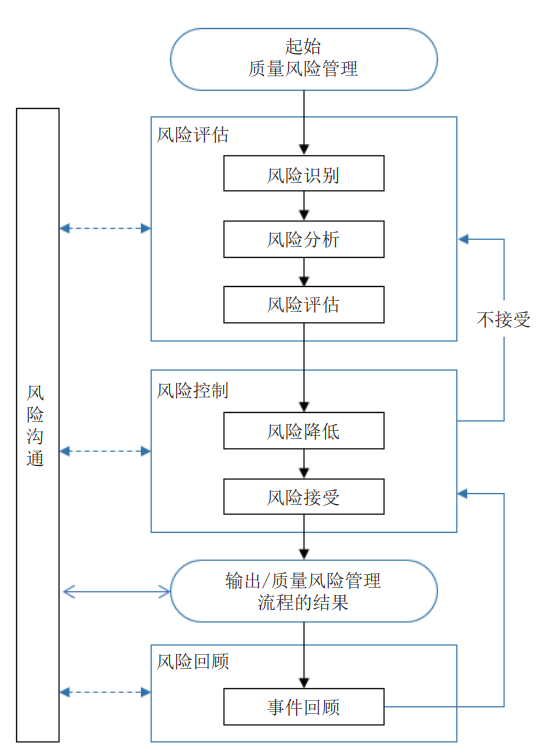
图 1 质量风险管理的一般流程 [33]
3.2 质量风险管理的方法和工具
ICH Q9 提供了一系列质量风险管理的方法和工具,包括基础的风险管理工具 ( 流程图、查检表、过程图、鱼骨图 ),失效模式与影响分析 (FMEA),失效模式、影响与危害分析 (FMECA),失效树分析 (FTA),危害分析与关键控制点 (HACCP),统计工具 ( 控制图、实验设计、帕累托图、直方图 ) 等。没有任何一种方法和工具能适用于所有情况的质量风险管理,需要根据具体的使用情况选择合适的方法与工具。
3.3 质量风险管理应用于特殊注射剂的研发
以 WAGHULE 等 [34] 在液晶纳米颗粒 ( liquid crystalline nanoparticles,LCNPs) 和 NAKAS 等 [35]在双氯芬酸钠明胶微球研究中的质量风险管理为例,介绍质量风险管理在特殊注射剂研发过程中的应用。
WAGHULE 等 [34] 基于 QbD 原理评估并定义了 LCNPs 的 CQAs,包括晶型、粒径和粒度分布、ζ 电位、黏度、包封率等。构建鱼骨图 ( 图 2) 对LCNPs 制备过程中的各种问题、影响及结果进行分析,从原料、设备、制备方法等 7 个方面识别了各种可能对制备过程产生影响的风险来源。在风险识别分析后,研究者通过 FMEA 法和使用基于相对风险的矩阵分析法,对影响 CQAs 的关键物料属性(critical material attributes,CMAs) 和关键工艺参数(critical process parameters,CPPs) 进行评估,确定了对 LCNPs 具有高风险的相关变量,如 CMAs 中API 的相对分子质量、pKa、晶型、粒径和粒度分布等,CPPs 中的混合温度以及超声振幅等。在实验设计(DoE) 中,建议采用全因子实验设计、部分析因实验设计、Plackett-Burman 设计等方法,建立输入和输出变量之间的数学关系,在此基础上确立相应的设计空间,为物料特性和工艺参数的选择提供更宽泛的操作面,从而对于 LCNPs 的整个制备过程形成完备理解和全面控制。
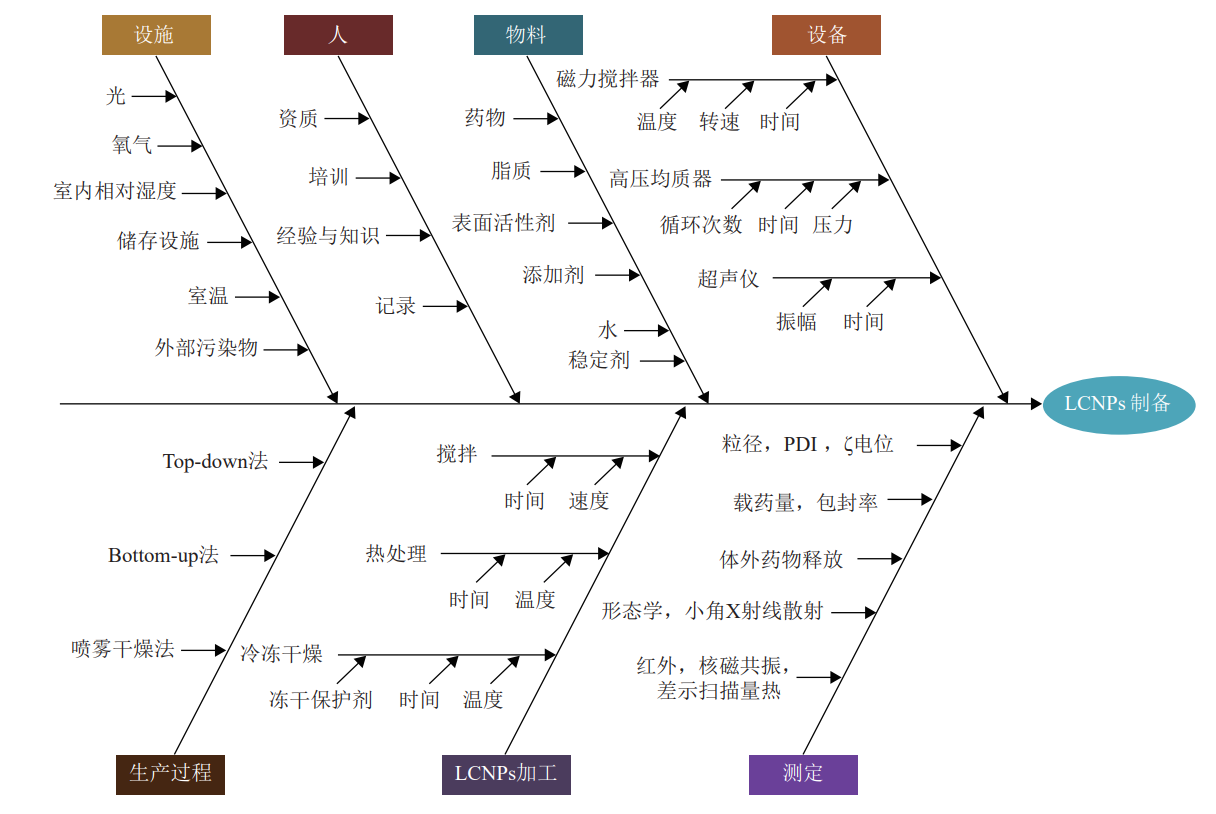
图 2 对 LCNPs 制备可能产生影响的因素的鱼骨图 [34]
NAKAS 等 [35] 首先确定双氯芬酸钠明胶微球的 CQAs 为 :微球的平均粒径、PDI、含量、降解产物、残留溶剂、药物溶出度、微生物含量。通过构建鱼骨图对影响微球 CQAs 的制备过程、物料和其他因素进行了风险识别。通过预先危险性分析(preliminary hazard analysis,PHA),明确了明胶属性、明胶浓度、油相类型、表面活性剂类型、油相浓度、表面活性剂浓度、乳化速度、乳化时间、交联剂浓度等 9 个可能影响微球 CQAs 的高风险因素。在后续研究中,采用 Plackett-Burman 设计进一步评估,又采用中心复合设计考察明胶用量和乳化速度对 CQAs 的影响。基于以上质量风险管理结果,最终确定了明胶微球的优化处方和工艺参数。
Part.04
结语
特殊注射剂相较于传统注射剂,在药物的靶向作用和缓控释方面具有更加显著的优势,目前虽然在全球范围内上市的产品不多,但其市场规模可观。特殊注射剂的研发难度大、产品技术壁垒高,基于QbD 理念进行制剂开发对于全面透彻地理解和掌控整个研发过程是不可或缺的。在研发过程中准确识别并评估特殊注射剂的 CQAs,采取科学的质量风险管理方法,是确保药品最终能够研发成功的重要环节。随着科学技术手段的不断进步,相信在不久的将来会有更多的特殊注射剂产品上市并应用于临床治疗,为广大患者带来福音。
参考文献
[1] 国家药品监督管理局药品审评中心.国家药监局药审中心关于发布《化学药品注射剂仿制药质量和疗效一致性评价技术要求》等3个文件的通告(2020年第2号)[EB/OL].(2020-05-14)[2023-01-18].https://www.cde.org. cn/main/news/viewInfoCommon/d9c6f118b773f54e8feba3519bf78a11.
[2] ICH.Pharmaceutical development Q8(R2)[EB/OL].(2009-08-01)[2023-01-18].https://database.ich.org/sites/default/files/Q8%28R2%29%20Guideline.pdf.
[3] 吴正红, 周建平.工业药剂学[M].北京: 化学工业出版社, 2021.
[4] 李 乐, 焦 杰, 周 卫.不同结构特征的微球制剂在药物递送中的研究进展[J].中国新药杂志, 2021, 30(17):1592-1599.
[5] 李 勋, 韦 祎, 马光辉, 等.缓释微球制剂的研究进展[J].北京化工大学学报(自然科学版), 2017, 44(6):1-11.
[6] 魏利军.特殊注射剂的发展现状与市场概况[J].药学进展, 2018, 42(12): 913-921.
[7] 谷文睿, 杨 雅, 马 欢, 等.脂质体药物递送系统研究进展及临床应用[J].中国药房, 2023, 34(4): 508-512.
[8] RIDEAU E , DIMOVA R , SCHWILLE P, et al.Liposomesand polymersomes: a comparative review towards cellmimicking [J].Chem Soc Rev, 2018, 47(23): 8572-8610.
[9] 武晨思, 耿丹丹, 王春艳, 等.阿瑞吡坦磷脂复合物静注亚微乳的制备及质量评价[J].沈阳药科大学学报, 2022,39(10): 1165-1173.
[10] MEDLICOTT N J, WALDRON N A, FOSTER T P.Sustained release veterinary parenteral products [J].AdvDrug Deliv Rev, 2004, 56(10): 1345-1365.
[11] 张 雪, 齐宜广, 武玉杰, 等.新型注射剂的国内外研发进展[J].药学进展, 2018, 42(12): 897-904.
[12] ZHANG C, YANG L, WAN F, et al.Quality by designthinking in the development of long-acting injectable PLGA/PLA-based microspheres for peptide and protein drugdelivery [J].Int J Pharm, 2020, 585: 119441.
[13] BOHR A, YANG M, BALDURSDÓTTIR S, et al.Particleformation and characteristics of celecoxib-loaded poly(lactic-co-glycolic acid) microparticles prepared in differentsolvents using electrospraying [J].Polymer, 2012, 53(15):3220-3229.
[14] LIN X, YANG H, SU L, et al.Effect of size on the in vitro/in vivo drug release and degradation of exenatide-loadedPLGA microspheres [J].J Drug Deliv Sci Technol, 2018,45: 346-356.
[15] GU B, SUN X, PAPADIMITRAKOPOULOS F, et al.Seeing is believing, PLGA microsphere degradation revealedin PLGA microsphere/PVA hydrogel composite [J].JControl Release, 2016, 228:170-178.
[16] FALCO N, REVERCHON E, DELLA PORTA G.InjectablePLGA/hydrocortisone formulation produced by continuoussupercritical emulsion extraction [J].Int J Pharm, 2013,441(1/2): 589-597.
[17] AN T, CHOI J, KIM A, et al.Sustained release ofrisperidone from biodegradable microspheres prepared by insitu suspension-evaporation process [J].Int J Pharm, 2016,503(1/2): 8-15.
[18] WANG T, XUE P, WANG A, et al.Pore change duringdegradation of octreotide acetate-loaded PLGA microspheres:the effect of polymer blends [J].Eur J Pharm Sci, 2019,138: 104990.
[19] SU Y, LIU J, TAN S, et al.PLGA sustained-releasemicrospheres loaded with an insoluble small-moleculedrug: microfluidic-based preparation, optimization,characterization, and evaluation in vitro and in vivo [J].Drug Deliv, 2022, 29(1): 1437-1446.
[20] 安广峰, 吕丕平.QbD理念在微球制剂开发中的应用[J].上海医药, 2021, 42(5): 77-81.
[21] 王笑笑, 王君吉, 赵 源, 等.质量源于设计(QbD)理念在脂质体开发中的应用[J].中国医药工业杂志, 2018,49(12): 1635-1643.
[22] FDA.Liposome drug products - chemistry, manufacturing,and controls; human pharmacokinetics and bioavailability;and labeling documentation [EB/OL].[2023-01-18].https://www.fda.gov/media/70837/download.
[23] NÉMETH Z, PALLAGI E, DOBÓ D G, et al.An updatedrisk assessment as part of the QbD-based liposome designand development [J].Pharmaceutics, 2021, 13(7): 1071.
[24] 杨 君.基于QbD理念的曲安奈德注射脂肪乳剂制剂研究[D].上海: 上海交通大学硕士学位论文, 2017.
[25] DENG Y, ZHONG G, WANG Y, et al.Quality by designapproach for the preparation of fat-soluble vitamins lipidinjectable emulsion [J].Int J Pharm, 2019, 571: 118717.
[26] STAWNY M, GOSTYŃSKA A, DETTLAFF K, et al.Effectof lipid emulsion on stability of ampicillin in total parenteralnutrition [J].Nutrients, 2019, 11(3): 559.
[27] MIKULCOVÁ V, KAŠPÁRKOVÁ V, HUMPOLÍČEK P, etal.Formulation, characterization and properties of hempseed oil and its emulsions [J].Molecules, 2017, 22(5): 700.
[28] 董武军, 叶 军, 吴朝阳.载药脂肪乳的质量控制进展[J].中国食品药品监管, 2019, (10): 34-40.
[29] 曾素梅, 蔡文坚, 曾少群, 等.湿法介质研磨技术制备注射用纳米混悬剂及其质量评价研究进展[J].中国医药工业杂志, 2022, 53(9): 1251-1261.
[30] JOSHI M, YADAV K S, PRABHAKAR B.Quality bydesign approach for development and optimization ofrifampicin loaded bovine serum albumin nanoparticles andcharacterization [J].Curr Drug Deliv, 2021, 18(9): 1338-1351.
[31] ELSHAGEA H N, ELKASABGY N A, FAHMY R H, etal.Freeze-dried self-nanoemulsifying self-nanosuspension(SNESNS): a new approach for the preparation of a highlydrug-loaded dosage form [J].AAPS PharmSciTech, 2019,20(7): 258.
[32] SHI J, WANG D, TIAN Y, et al.Comparison of paliperidone palmitate from different crystallization processes and effecton formulations in vitro and in vivo [J].Pharmaceutics,2022, 14(5): 1094.
[33] ICH.Quality risk management Q9(R1)[EB/OL].(2023-01-18)[2023-01-18].https://database ich org/sites/default/files/ICH_Q9%28R1%29_Guideline_Step4_2023_0126_0.pdf.
[34] WAGHULE T, DABHOLKAR N, GORANTLA S, etal. Quality by design (QbD) in the formulation andoptimization of liquid crystalline nanoparticles (LCNPs): arisk based industrial approach [J].Biomed Pharmacother,2021, 141: 111940.
[35] NAKAS A, DALATSI AM, KAPOURANI A, et al.Qualityrisk management and quality by design for the developmentof diclofenac sodium intra-articular gelatin microspheres[J].AAPS PharmSciTech, 2020, 21(4): 127.
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..