国内创新药IND汇总

1、海思科:HSK44459片
作用机制:——
适应症:间质性肺疾病
5月29日,海思科的HSK44459片的临床试验申请(IND)获CDE受理。HSK44459片是海思科自主研发的一个全新的具有独立知识产权的治疗间质性肺疾病的药物;临床前研究表明,该药物靶点明确、疗效确切、安全性好,是一款极具开发潜力的小分子药物,临床应用的效益/风险比高。间质性肺疾病是一组主要累及肺间质和肺泡腔,导致肺泡-毛细血管功能单位丧失的弥漫性肺疾病;临床主要表现为进行性加重的呼吸困难、限制性通气功能障碍伴弥散功能降低、低氧血症以及影像学上的双肺弥漫性病变。间质性肺疾病包括二百多种急性和慢性肺部疾病,其中大多数疾病的病因还不明确。
2、舜景生物:SGC001注射液
作用机制:——
适应症:急性心肌梗死
5月29日,舜景生物的SGC001注射液的IND获CDE受理。SGC001是舜景医药孙志伟研发团队联合首都医科大学北京市心肺血管疾病研究所杜杰教授团队共同开发研制的急救用单克隆抗体药物,适用于急性心肌梗死患者的急救治疗。临床前药效学模型研究和毒理学研究显示,SGC001对心梗后心衰及心脏病理性重塑有明显的治疗作用,可以显著降低心梗的死亡率,减少心肌梗死面积,改善心功能,具有较好的疗效,具有first-in-class的潜力。
3、蓝纳成生物:177Lu-LNC1011注射液
作用机制:靶向PSMA的核药
适应症:去势抵抗前列腺癌
5月30日,蓝纳成生物的177Lu-LNC1011注射液的IND获CDE受理。LNC1011是东诚药业旗下蓝纳成生物开发的一款基于177Lu的新型、长循环靶向PSMA的放射性治疗药物;该药物于2023年10月开展IIT研究,重点关注转移性去势抵抗性前列腺癌患者;该研究采用标准的 3+3 剂量递增设计,在 6 周内以 1.85 GBq (50 mCi)的剂量开始治疗,随后的队列接受连续 50% 的剂量递增,直到观察到剂量限制毒性 (DLT)。结果显示,两周期的177Lu-LNC1010 PRRT已显示出初步疗效,其中5例(42%)患者达到部分缓解(PR),5例(42%)患者疾病稳定(SD),而2例(18%)患者治疗后出现疾病进展(PD);疾病控制率(DCR)达到83%,总缓解率(ORR)为42%。所有患者对177Lu-LNC1010的耐受性良好,4例患者(4/12,33%)观察到轻度的不良反应,表现为G1期腹痛(2/12,17%)、G1期呕吐(1/12,8%)和G2期乏力(1/12,8%);83%的患者(10/12)观察到与177Lu-LNC1010治疗相关的亚急性血液学毒性,其中出现G3/G4血液毒性的患者占3例(3/12,25%)。基于以上数据,未来II期临床试验的推荐剂量为3.33 GBq/周期。
全球新药NDA情况
1、罗氏:Inavolisib
作用机制:PI3Kα抑制剂
适应症:乳腺癌
5月29日,罗氏的Inavolisib的新药申请(NDA)已被FDA受理并纳入优先审评,用于联合哌柏西利和氟维司群治疗既往接受内分泌疗法辅助治疗后或完成辅助内分泌治疗后12个月内复发的PIK3CA突变、激素受体阳性(HR+)、人表皮生长因子受体2阴性(HER2-)的局部晚期或转移性乳腺癌成人患者,PDUFA日期定为2024年11月27日。Inavolisib是一种口服药物,高选择性抑制PI3Κα 并且能特异性降解PI3Κα 突变蛋白。PIK3CA 突变可导致PI3Κα 蛋白改变,从而导致肿瘤生长失控、疾病进展和对内分泌治疗耐药。凭借这种独特的双重作用机制,inavolisib 可以为PIK3CA 突变的HR 阳性/HER2 阴性晚期乳腺癌患者提供良好的耐受性、持久的疾病控制并可能改善预后。III 期NAVO120研究显示,inavolisib 联合哌柏西利和氟维司群,可作为PIK3CA 突变的HR 阳性、HER2 阴性、内分泌耐药的局晚或转移性乳腺癌患者的一线治疗选择,研究达到无进展生存期(PFS)的主要终点,与单用哌柏西利和氟维司群相比,inavolisib 联合治疗组显示出有统计学意义和临床意义的显著延长(15.0 vs. 7.3个月,HR=0.43,P<0.0001);此外,inavolisib 联合治疗耐受性良好,不良反应与已知安全性特征一致,未观察到新的安全信号。
全球新药III期临床汇总
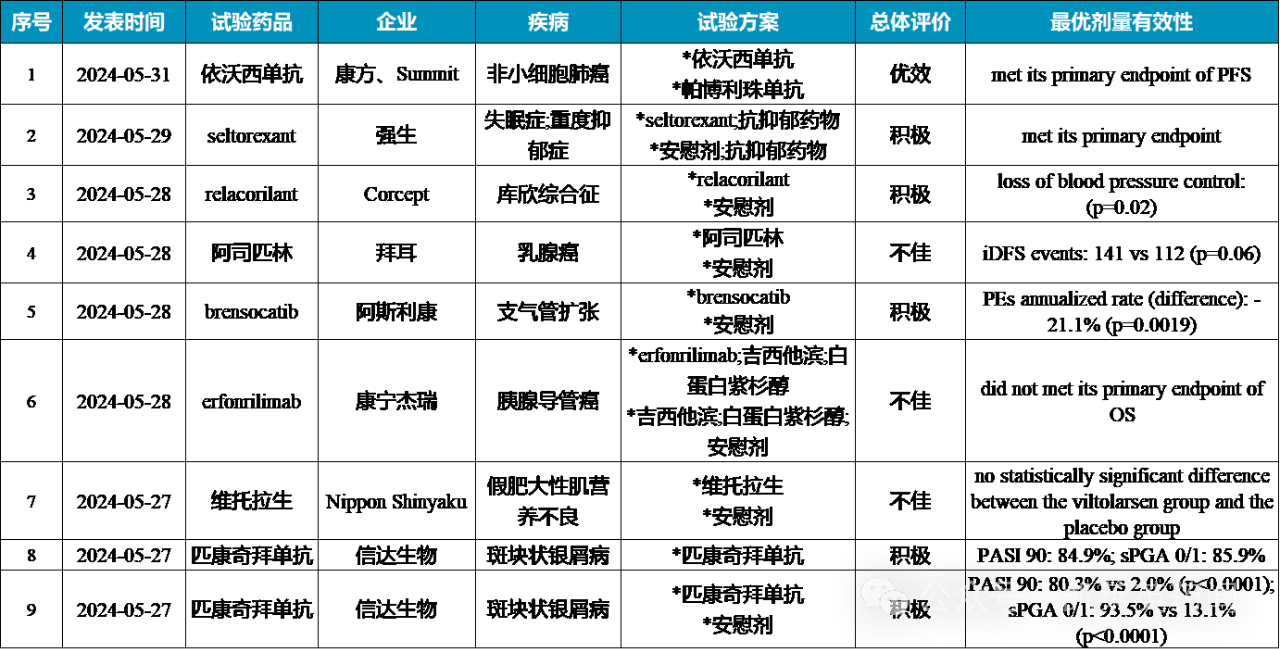
5月31日,康方生物的依沃西单抗注射液在单药对比帕博利珠单抗一线治疗PD-L1表达阳性的局部晚期或转移性非小细胞肺癌(NSCLC)的注册性III期临床研究中,达到无进展生存期(PFS)的主要研究终点,其中在PD-L1 TPS 1-49%和PD-L1 TPS ≥50%的人群中,PFS获益均非常显著;此外,各个亚组疗效分析均显示强阳性结果,包括鳞癌、非鳞癌,有/无肝转移、有/无脑转移等患者人群。总体安全性良好,无新的安全性信号。详细数据预计将于即将举行的全球学术会议上公布。
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..