(收集周期:5.13-5.17,国内部分包含首次申请临床的创新药)
国内创新药IND汇总

1、一品红制药:APH01727片
作用机制:GLP-1受体激动剂
适应症:减重、II型糖尿病
5月13日,一品红制药的APH01727片的临床试验申请获CDE受理。APH01727是公司自主研发的一种高活性高选择性的小分子胰高血糖素样肽-1受体 (GLP-1R) 激动剂,每天一次口服用于2型糖尿病、超重/肥胖患者的治疗。多肽容易在肠道环境下发生分解,同时大分子在胃肠道表皮会遇到渗透性问题;因此多肽的口服剂型相比注射剂型在设计时需要进行一定的调整,包括药物结构调整配合吸收增强剂、添加抑制降解酶活性的保护、配合给药装置等,设计和工艺较为复杂。相比之下,化学小分子药物的稳定性和药代动力学都具有一定的优势。
2、威斯津生物:WGc-043注射液
作用机制:——
适应症:EB病毒相关肿瘤
5月14日,威斯津生物的WGc-043注射液的临床试验申请获CDE受理。WGc-043运用了威斯津生物在mRNA领域获得的突破性技术,包括递送载体、序列设计以及放大化生产等方面的最新研发成果。该药物能通过激活患者自身的抗肿瘤免疫,在体内生成杀伤肿瘤的细胞毒性T细胞(CTLs)、抗原特异性抗体以及记忆性T细胞,相当于CAR-T和单克隆抗体联合抗肿瘤的效果,还可以避免肿瘤复发,具有更高效的抗癌效果及优越的安全性。此前,该药物获FDA批准开展临床试验,拟用于:(1)经过二线系统治疗的EB病毒阳性晚期实体瘤成人患者;(2)复发或难治性的病毒性阳性血液瘤成人患者。
3、远大:重组带状疱疹疫苗(CHO细胞)
作用机制:——
适应症:带状疱疹感染
5月14日,远大赛威信的重组带状疱疹疫苗(CHO细胞) 的临床试验申请获CDE受理。该重组带状疱疹疫苗采用具有全球自主知识产权的TVA01新佐剂系统,临床前药效显示细胞免疫与体液免疫效果均优于GSK已上市疫苗,安全性较好。远大赛威信专注于治疗性疫苗及新型疫苗研发,拥有以大肠杆菌和酵母重组疫苗平台、规模化发酵平台、蛋白疫苗纯化工艺平台、重组疫苗VLP质量鉴定平台、免疫评价平台为主的疫苗开发核心技术平台;同时,公司还拥有重组蛋白疫苗和细菌疫苗中试车间、A2动物安全实验室及P2生物安全实验室,约10000平米,可满足研发、中试生产、临床I期和II期临床样品制备需求。
4、海思科:HSK39004吸入混悬液
作用机制:——
适应症:气道阻塞性肺病
5月14日,海思科的HSK39004吸入混悬液的临床试验申请获CDE受理。HSK39004是海思科自主研发的全新的具有独立知识产权的靶向小分子抑制剂,临床拟用于气道阻力为特征的阻塞性肺病(如COPD、哮喘)的治疗。临床前研究显示,在离体气管环和体内疾病模型中,HSK39004表现出显著的气道舒张和抗炎作用,且安全性良好,有望为COPD、哮喘等阻塞性肺病患者提供一种新的治疗选择。
5、信达生物:IBI3003
作用机制:靶向BCMA/CD3/GPRC5D三抗
适应症:多发性骨髓瘤
5月14日,信达生物的IBI3003的临床试验申请获CDE受理。IBI3003是一款靶向BCMA/CD3/GPRC5D的三抗,其重链之间则引入Knob-into-hole技术。该药物去年10月启动了一项针对针对复发或难治性多发性骨髓瘤患者的I/II期临床试验,已于今年2月完成首例受试者的入组。
6、博安生物:注射用BA1302
作用机制:靶向CD228 ADC
适应症:肿瘤
5月15日,博安生物的注射用BA1302的临床试验申请获CDE受理。BA1302是一种靶向CD228的ADC,采用半胱氨酸偶联技术,DAR值约为4;其抗体部分筛选自公司自有知识产权的全人抗体转基因小鼠BA-huMab®,只结合膜形式的CD228而不结合其可溶形式sMFI2,具有更好的结合特异性;连接子为MC-β-Ala-(glucuronide)PAB;载荷采用微管蛋白抑制剂单甲基澳瑞他汀E(MMAE)。临床前研究显示,在肺癌、胃癌及黑色毒瘤等肿瘤模型中,BA1302表现出优异的肿瘤抑制效果,且在食蟹猴毒理预实验中安全耐受性良好。
7、GSK:Dostarlimab注射液
作用机制:抗PD-1单抗
适应症:肿瘤
5月17日,GSK的dostarlimab注射液的临床试验申请获CDE受理。Dostarlimab是一款人源化抗PD-1单克隆抗体,与PD-1受体结合,并阻断其与配体PD-L1和PD-L2的相互作用。目前,该药物已经在美国获得批准(商品名:Jemperli),作为在先前接受过含铂疗法后的dMMR 晚期或复发性子宫内膜癌的单药治疗。该适应症的批准主要基于单组、多队列GARNET研究的数据,结果显示:数据截止时的中位随访时间为11.2个月,Jemperli单药治疗的ORR为42%(95%CI; 31%-55%),其中13%(9/71)为完全缓解,疾病控制率为58%(95%CI; 45%-69%),DOR尚未成熟(1.87+至19.61+个月);在安全性上,Jemperli耐受性良好,与治疗有关的不良事件(TRAE)导致的停药率低(2%),不良事件与其他PD-1药物一致,最常见的是乏力(15%),腹泻(15%),疲劳(14%)和恶心(13%),未报告Jemperli治疗相关的死亡事件。
8、信达生物:IBI3004
作用机制:靶向DR5/CEA双抗
适应症:实体瘤
5月17日,信达生物的IBI3004的临床试验申请获CDE受理。IBI3004是一款靶向DR5和CEA双抗,其中,抗体类药物所诱导的DR5受体激活可引发肿瘤细胞凋亡的信号通道,进而促使程序性细胞凋亡;CEACAM5(CEA)在结直肠癌、非小细胞肺癌、胰腺癌和胃癌等上皮性肿瘤细胞的表面广泛表达,而在正常组织中表达较少,因而是肿瘤靶向治疗的潜在靶点。
9、默克雪兰诺:注射用M9140
作用机制:抗CEACAM5 ADC
适应症:肿瘤
5月17日,默克雪兰诺的注射用M9140的临床试验申请获CDE受理。M9140是一种抗CEACAM5 ADC,具有拓扑异构酶1抑制剂有效载荷,具有循环稳定性、卓越的癌细胞杀伤活性以及较长半衰期;同时,M9140与DDR抑制也具有协同起效的优势。
全球新药上市获批
1、安进:Tarlatamab
作用机制:靶向CD3/DLL3双抗
适应症:广泛期小细胞肺癌
5月16日,安进的tarlatamab(商品名:Imdelltra)获FDA加速获批,用于治疗广泛期小细胞肺癌(ES-SCLC)成人患者。Tarlatamab是一款双特异性T细胞结合器(BiTE),通过同时靶向T细胞上的CD3和肿瘤细胞上的DLL3,一方面激活T细胞反应,另一方面拉近T细胞和肿瘤细胞,提升对肿瘤细胞的杀伤作用。2期临床数据显示,中位随访期为10.6个月时,包含100例接受选定10 mg剂量tarlatamab治疗患者的意向治疗分析ORR为40%(97.5% CI:29,52),关键次要终点mPFS为4.9个月(95% CI:2.9,6.7),mOS为14.3个月(95% CI:10.8,NE)。在安全性上,因治疗相关不良事件(TRAE)导致的停药不常见(4%)。Tarlatamab 10 mg组患者报告的最常见治疗中出现的不良事件(TEAE)为细胞因子释放综合征(CRS;49%)、发热(38%)、食欲下降(25%)和味觉障碍(24%)。CRS主要限于第1次和第2次给药,主要为1级或2级,通常可通过支持治疗进行管理。在tarlatamab 10 mg剂量组,3级CRS发生率较低(0%),未观察到3级免疫效应细胞相关神经毒性综合征(ICANS)和相关神经系统事件(0%)。1名患者死亡被认为与治疗相关。
SCLC约占肺癌15%,全球每年新发病例数超过33万例。SCLC侵袭性强,初治后的中位生存期约为12-13个月,其中占比70%的ES-SCLC五年生存率低于3%,仍相对缺乏治疗手段。
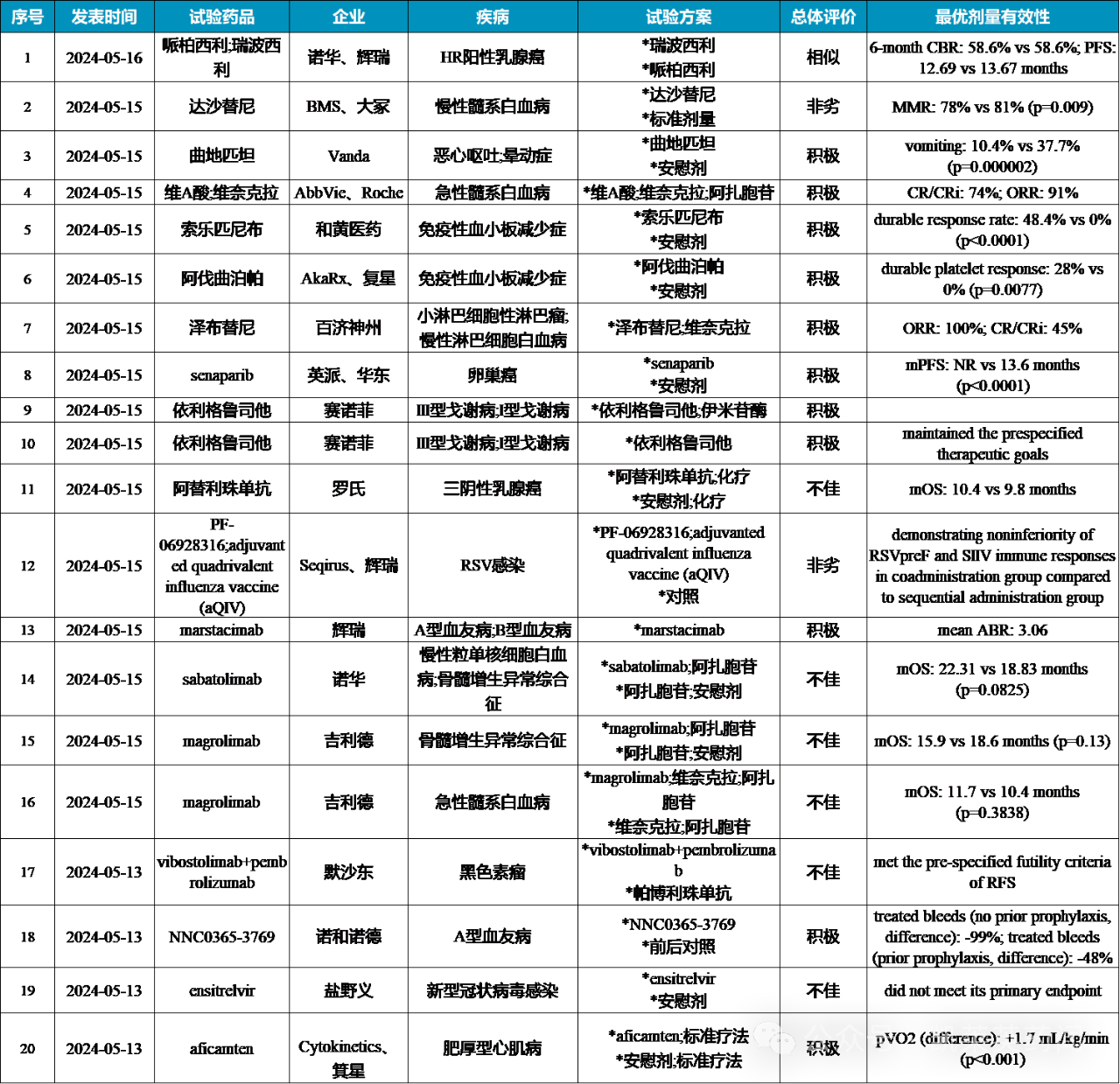
全球新药III期临床汇总
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..