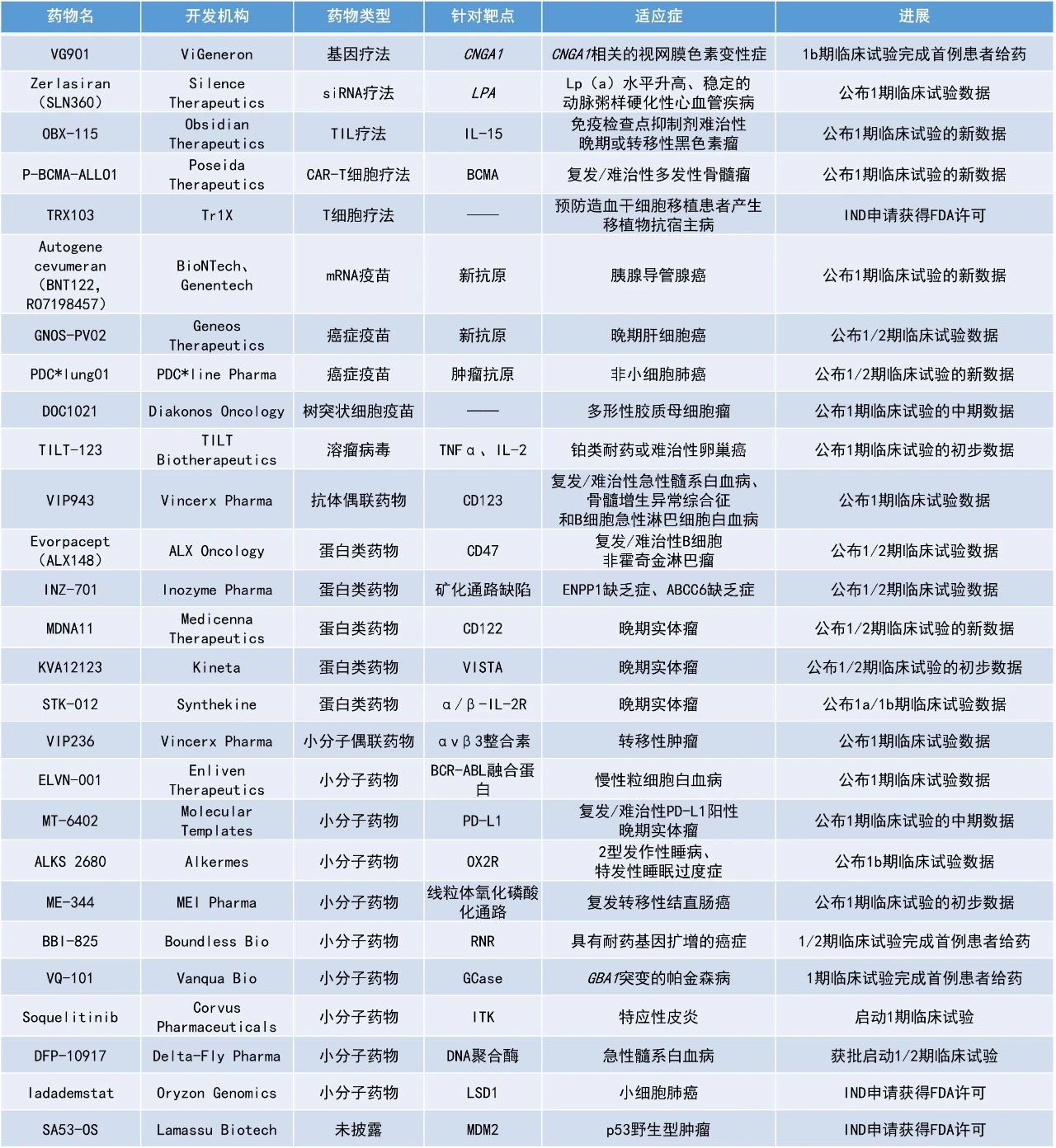
1. 个体化治疗性癌症疫苗GNOS-PV02联用PD-1抑制剂与PD-1抑制剂单药相比,在一项早期临床试验中使晚期肝癌患者的总缓解率(ORR)近翻倍,患者的中位总生存期(mOS)获大幅延长。
2. 癌症疫苗PDC*lung01联用PD-1抑制剂一线治疗转移性非小细胞肺癌(NSCLC),在一项1/2期临床试验中的疾病控制率(DCR)高达94.7%。
3. CD47抑制剂evorpacept联用利妥昔单抗和来那度胺治疗惰性和侵袭性复发/难治性B细胞非霍奇金淋巴瘤(B-NHL),在一项1/2期临床试验中的ORR为94%,完全缓解(CR)率为83%。
4. 长效IL-2超级激动剂MDNA11治疗晚期实体肿瘤,使1例转移性胰腺导管腺癌(PDAC)患者在基线时存在的所有病变完全消退。
药明康德内容团队整理
GNOS-PV02:公布1/2期临床试验数据
Geneos Therapeutics公司公布其个体化治疗性癌症疫苗GNOS-PV02的1/2期临床试验全部入组患者的安全性、免疫原性和疗效数据。这项试验中使用的癌症疫苗是一款DNA质粒递送的新抗原疫苗。该公司通过对每例患者的肿瘤进行测序,发现基于每个患者独特的肿瘤突变产生的新抗原,然后将表达这些新抗原的DNA序列导入到DNA质粒中。这种基于DNA的个体化治疗性癌症疫苗可能包含多达40种新抗原。
此次公布的结果显示,该试验达到了安全性和免疫原性的主要终点,以及基于缓解率的疗效次要终点。在36名晚期肝癌患者中,有11名(30.6%)对该疫苗与PD-1抑制剂Keytruda联合疗法产生缓解,这大约是过去对照药物缓解率的两倍。其中3例患者达到了CR,8例患者达到了部分缓解(PR)。数据截止时,患者的mOS为19.9个月,而先前报道的Keytruda和其他PD-1抑制剂单药用于二线治疗时的mOS范围为12.9-15.1个月。
此外,免疫学分析证实,在14名可评估的患者中,100%的患者出现了对疫苗编码的新抗原的新T细胞反应。单细胞测序分析显示,这些T细胞克隆中的绝大多数是CD8 T效应记忆细胞,这是诱导抗肿瘤细胞毒性的关键细胞。
PDC*lung01:公布1/2期临床试验的新数据
PDC*line Pharma公司公布了其用于NSCLC患者的现货型治疗性癌症疫苗候选药物PDC*lung01单药或与抗PD-1治疗联用的1/2期临床试验中最后一批患者的中期数据。浆细胞样树突状细胞(PDC)系是一种有效的专业抗原呈递细胞系,能够激发和增强患者的抗肿瘤细胞毒性CD8+ T细胞,并能与抗PD-1治疗协同作用。PDC*lung01是由7种活性组分组成的细胞悬液,装载着多种肿瘤抗原。
此次公布的数据显示,中位随访时间为12.5个月时,在19例可评估的患者中,高剂量PDC*lung01与pembrolizumab联用一线治疗IV期(转移性)NSCLC患者的DCR为94.7%,ORR为63.2%,获得缓解的患者均为PR。患者的中位无进展生存期(mPFS)为10.9个月,中位缓解持续时间为9.49个月。
Evorpacept(ALX148):公布1/2期临床试验数据
ALX Oncology公布了其CD47抑制剂evorpacept(ALX148)联用利妥昔单抗和来那度胺治疗惰性和侵袭性复发/难治性B细胞非霍奇金淋巴瘤的1/2期临床试验数据。Evorpacept是一种下一代CD47阻断疗法,它将高亲和性CD47结合结构域与经特殊处理的Fc结构域相结合,因此无法激活Fc受体,有望降低CD47靶向抗体因激活Fc受体可能产生的毒副作用。此外,与其它抗CD47抗体相比,evorpacept的分子量更小,更容易渗透到实体瘤中,从而提高疗效。截至目前,evorpacept已在500多名受试者中使用,并在与各种抗癌抗体联用时,在一系列血液和实体恶性肿瘤中显示出良好的活性和耐受性。
该研究中,20名惰性和2名侵袭性复发/难治性B-NHL患者接受了evorpacept联用利妥昔单抗和来那度胺的治疗,该组合疗法的耐受性良好,安全性与利妥昔单抗联用来那度胺相似,未报告剂量限制性毒性。接受evorpacept联用利妥昔单抗和来那度胺的患者的最佳ORR为94%,83%的患者实现了CR。与之相比,在先前的一项3期基准试验中,接受利妥昔单抗联用来那度胺的此类患者的ORR为78%,CR率为34%。
MDNA11:公布1/2期临床试验的新数据
Medicenna Therapeutics公司公布了其下一代长效IL-2超级激动剂MDNA11治疗晚期实体瘤的新临床结果。MDNA11具有优秀的CD122(IL-2受体β)结合作用,而没有CD25(IL-2受体α)亲和力,从而能优先刺激癌症杀伤效应T细胞和NK细胞。
此次公布的结果显示,MDNA11的耐受性良好,没有报告剂量限制毒性和血管渗漏综合征。截至2024年3月22日的数据,14例患者中有4例达到了PR,3例达到了疾病稳定(SD),ORR为29%,DCR为50%。MDNA11已使3名转移性黑色素瘤患者获得了6个月至18个月的持久SD,并且这些患者的肿瘤有缩小。第66周时,1例转移性胰腺导管腺癌患者在基线时存在的所有病变均完全消退。一例双检查点抑制剂治疗后进展的黑色素瘤患者的靶病灶在第28周时完全消退,非靶病灶在第36周持续缩小。
Autogene cevumeran(BNT122,RO7198457):公布1期临床试验的新数据
BioNTech公司在2024年美国癌症研究协会(AACR)年会上,公布了其针对胰腺导管腺癌的个体化癌症疫苗autogene cevumeran的临床试验随访成果。Autogene cevumeran是基于BioNTech的iNeST癌症疫苗技术平台生成的个体化新抗原疫苗,它可以编码数十种新抗原,旨在激发人体针对肿瘤细胞产生更为全面的免疫反应,防止肿瘤细胞逃避免疫系统的攻击。
此前公布的结果显示,16名接受过手术治疗的患者在atezolizumab治疗后接受了autogene cevumeran治疗。在这16人中,8人(50%)产生了T细胞免疫反应,由疫苗诱导产生了大量新抗原特异性的T细胞——其中一半的T细胞可以靶向一种以上的新抗原。
此次公布的分析表明,患者在接种PDAC癌症疫苗3年后,体内的T细胞免疫应答持续激活,并且患者的无复发生存期(RFS)得到了持续的延长。这一结果印证了该癌症疫苗的免疫持久性。
DOC1021:公布1期临床试验的中期数据
Diakonos Oncology公司公布了其树突状细胞疫苗DOC1021用于治疗多形性胶质母细胞瘤(GBM)患者的1期开放标签试验的中期分析结果。该公司的树突状细胞疫苗由患者自身的免疫细胞与从肿瘤样本中提取的RNA和蛋白质结合制成。这种独特的方法可以靶向完整的癌症抗原谱,而无需进行任何基因修饰。通过利用天然的免疫信号通路,这种策略使免疫系统能将癌细胞视同病毒感染的细胞一样进行识别和清除。
此次公布结果时,GBM患者的mOS期尚未达到,但有望大幅超过接受标准治疗(SOC)患者12.7个月的预期mOS。平均随访时间为12.9个月时,16名新确诊的GBM患者中有12名仍然存活,且未发生可归因的严重不良事件。2021年10月入组的首例GBM患者已存活了两年多。尽管接受的治疗剂量不到预计治疗剂量的25%,接下来入组的4名患者中的每一位都存活了15个月以上,其中两名在20.3个月和17.5个月时仍然存活。MGMT未甲基化GBM患者目前的12个月生存率为88%,而接受SOC的MGMT未甲基化GBM患者的12个月生存率仅为53%。
OBX-115:公布1期临床试验的新数据
Obsidian Therapeutics公司公布了其肿瘤浸润淋巴细胞(TIL)疗法OBX-115用于晚期或转移性黑色素瘤患者的1期临床试验的最新进展,包括25周的中期研究随访安全性数据和最新的详细疗效数据。OBX-115是一种新型工程化的TIL疗法,该TIL具有表达于细胞膜上受调节的白介素-15(IL-15)蛋白,因此患者在接受OBX-115治疗时不需要同时接受传统TIL治疗方案中要求的高剂量IL-2。临床前数据显示,与未经改造的TIL疗法相比,OBX-115具有增强的持久性与效力,动物模型的肿瘤控制得到改善,因此具潜力改善不同类型实体瘤患者的临床结果。
此次公布的结果显示,OBX-115的耐受性良好,与使用高剂量IL-2的非工程化TIL疗法具有差异化的安全性,未报告剂量限制性毒性和≥4级的非血液学事件。OBX-115诱导了深入且持久的缓解,ORR为50%,其中CR率为33%,mPFS尚未达到,6个月无进展生存率为67%。此外,所有患者在接受治疗后肿瘤负荷有所减轻,疾病控制时间≥12周。
TILT-123:公布1期临床试验的初步数据
TILT Biotherapeutics公司公布了其溶瘤病毒疗法TILT-123联合Keytruda治疗铂类耐药或难治性卵巢癌的1期临床试验的安全性和有效性数据。TILT-123是一种溶瘤腺病毒,不但能够在肿瘤内部复制、裂解肿瘤并且释放肿瘤相关抗原,还可以产生免疫刺激细胞因子TNFα和IL-2。该病毒的另一个优势是它不会在正常细胞中繁殖,而且可以使用肿瘤内注射或者静脉注射给药。TILT-123在临床前癌症模型中表现出100%的缓解率。
这项研究中,患者接受了瘤内或腹膜内注射TILT-123联合静脉注射Keytruda的治疗。结果显示,71%可评估患者的疾病得到了控制,其中一名粘液腺癌患者获得了长期PR。注射和未注射的肿瘤都出现了肿瘤体积缩小和显著的免疫调节,这表明该疗法有可能导致全身性的缓解。
ELVN-001:公布1期临床试验数据
Enliven Therapeutics公司公布了其小分子激酶抑制剂ELVN-001治疗复发/难治性或对现有酪氨酸激酶抑制剂(TKI)不耐受的慢性髓系白血病(CML)患者的1期临床试验的积极数据。ELVN-001是一种强效、高选择性、潜在“best-in-class”的小分子激酶抑制剂,专门针对CML患者的致癌驱动因子BCR-ABL融合蛋白。ELVN-001还具有针对耐药性最强的BCR-ABL1耐药突变体T315I和其他已知耐药突变体的活性。
截至2024年3月18日的数据,ELVN-001的耐受性良好,未报告≥3级治疗相关的非血液学毒性反应。治疗12周时,既往接受过asciminib和/或对TKI耐药的患者的初始累积主要分子缓解(MMR)率为44%(7/16),与已获批的BCR-ABL1酪氨酸激酶抑制剂在1期临床试验中的数据相比具有优势。在可评估的患者中,所有患者在12周时BCR-ABL1融合蛋白的转录水平都有改善或保持稳定。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..