引言
从靶向治疗到免疫治疗,国内处于跟跑阶段,ADC到了并跑阶段,一些临床研究的技术方面甚至处于领跑阶段。靶点方面:从过去靶向于肿瘤的靶点,逐步扩展到靶向肿瘤微环境,开始出现多元化的趋势。虽然现在很多靶点仍是概念性的,慢慢会走向临床。
机制上:新一代ADC也并不仅是将药物输送至肿瘤的“特洛伊木马”。未来的5-10年是药物递送的5-10年,回归到ADC这个创新赛道,中国企业怎么做全球差异化创新?值得深入思考及与临床互动。
2023年9月,宋正波主任受邀在BiG ADC专题研讨会上作主题报告:【研究者视角下-ADC早期临床研究】深受听众好评,现分享以飨读者。

作者|宋正波-浙江省肿瘤医院Ⅰ期临床试验病房主任
编辑|BiG媒体部
* 本文系BiG媒体部会后整理,可能存在疏漏,仅供行业参考交流,不构成任何投资及用药建议。
01 ADC在肺癌临床研究中的惊喜和启示
案例一:DS8201在HER2突变NSCLC中的临床研究启示
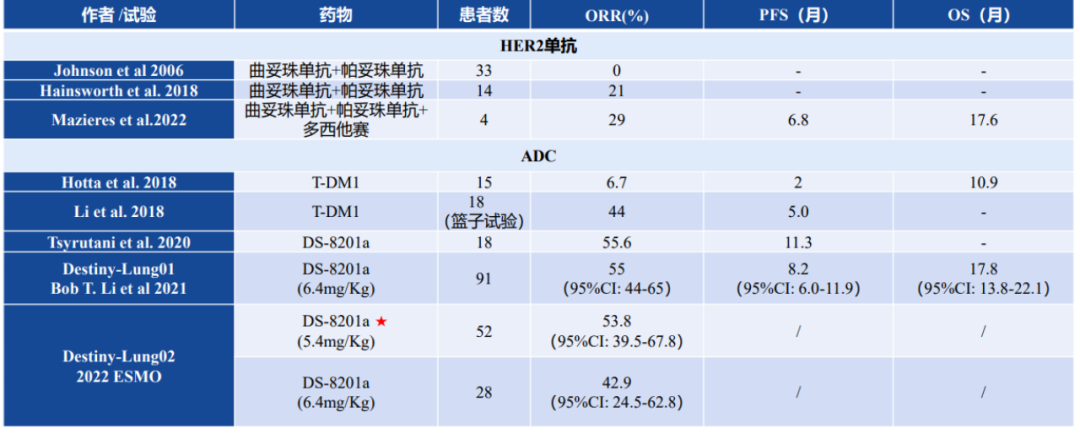
肺癌 HER2 主要临床试验
对于HER2突变NSCLC患者来说,阿法替尼治疗泛HER NSCLC只有3个月的PFS,吡咯替尼只有5~6个月的PFS,我们需要有更好的药物出现。
DS8201在肺癌中的临床研究快速推进了DS8201在HER2肺癌中的FDA批准,中位PFS是8.2个月,虽然这个疗效在临床中也不够满意,但是它开创了一个新的时代。
吡咯替尼和ADC有没有冲突呢?我们在临床中入组了大量小分子药物经治的病人,再序贯ADC之后不影响整体疗效。其实ADC给这类病人打开了一扇新窗户,至少有一部分病人中位PFS可以达到8个月,未来通过优化、联合等手段还可以不断延长PFS。
其次,比较意外的是,DS8201在不同的HER2突变NSCLC都有反应,即使没有检出HER2表达/扩增的患者同样对T-DXd有反应。这个研究的亚组分析告诉我们HER2的过表达跟疗效总体来讲没有特别大的关系,这似乎颠覆了我们过去对HER2的认识,具体机制需要科学上的进一步探索。
此外:还有很多问题,比如DAR越高越好吗?可裂解连接子更好吗?旁观者效应更好吗?当前诸多研究告诉我们,合理的DAR值可以平衡疗效和毒性,所以DAR值高了不一定好。
案例二:SHR-A1811在HER2突变NSCLC中的临床研究启示
恒瑞医药HER2 ADC注射用SHR-A1811拟纳入突破性治疗品种,适应症为:单药治疗既往含铂化疗失败的HER2突变的晚期非小细胞肺癌(NSCLC)患者。
这个过程中也跟DS8201做了各种各样的比较,最后确定4.8mg/kg作为II期推荐剂量(RP2D)的剂量,这和乳腺癌是不一样的剂量,还是需要有一些勇气去推的。
去年AACR 年会报道了SHR-1811的疗效数据。初步结果显示,相比DS8201,在入组了更多脑转移、转移部位更多的病人情况下,疗效数据跟DS8201结果接近。
案例三:Dato-DXd治疗晚期NSCLC打响了去铂的第一枪
在临床中,临床医生一直希望找到一些高效低毒的药物,我们从二线的单药免疫到一线免疫联合化疗,又在免疫联合化疗的基础上联合抗血管生成药物,甚至再加一个免疫治疗,不断去做加法,但做加法的时候始终离不开化疗,化疗的不良反应很大,但它又是一个基石,所以未来我们希望ADC能替代化疗,带来一个新的里程碑。
在2023年 ASCO年会上,靶向TROP2的ADC药物Datopotamab Deruxtecan(Dato-DXd)治疗晚期NSCLC的TROPION-Lung02研究公布了更新数据,进一步证实了Dato-DXd联合帕博利珠单抗±铂类化疗在初治或经治且无可靶向基因组改变的晚期NSCLC患者中的显著疗效和良好安全性,这给了我们一些希望,因为“ADC药物+PD-1”,并没有逊色于“ADC药物+PD-1+卡铂”,打响了去铂的第一枪。
案例四:SKB264旨在建立EGFR TKI耐药NSCLC新治疗标准
临床中的肺癌还有一个众所周知的阴影:耐药。我个人认为非小细胞肺癌最大的问题就是耐药,科伦的SKB264今年给了我们很多惊喜,在晚期经TKI治疗的EGFR突变的人群中ORR达到了60%,PFS达到11个月。科伦已经启动头对头和含铂两药化疗的比较,这项研究的目的是奠定在EGFR TKI耐药NSCLC患者中的治疗标准,现在的治疗标准是PD-1+含铂两药化疗+贝伐珠单抗,中位PFS为5-6个月。
02 ADC药物当前问题
ADC给我们带来了很多希望,但也存在很多问题:
● 药物定性,ADC是化疗药还是生物药?
为什么要定性?临床中的ADC有中度的胃肠道反应,跟化疗药物是类似的,而且有血相下降、白细胞下降、血小板下降等问题,化疗不能长期耐受,如果我们将其归入到化疗类,临床医生可以在ADC达到一定疗效后停掉,或者拉长时间,病人不能无休止地用,我们现在在这类病人中积累的数据比较少,长期用药超过一年的病人不多。所以它是一个暂时未知的定性问题。
● 令人担忧的 ADC 疗效
比如Trop-2 ADC在乳腺癌中只有5-6个月的PFS,肺癌中只有8个月的PFS,而EGFR TKI一代有10~12个月,二代是13个月,三代是19个月,所以ADC明显比现有的靶向药物差,而且不管怎么样优化现有的ADC只有这个疗效,除非做联合,但是联合的毒性就出来了。
● Payload具有器官特异性
我们在肺癌中做了很多HER2的MMAE药物,相对成功率较低一些。MMAE比较容易在泌尿系统肿瘤和胃癌中成功,个人觉得探索MMAE作为毒素的ADC药物相对要谨慎。这也提醒科学家要跟临床医生密切地沟通,讨论有没有开发前景。
脑转移的问题怎么解决?尽管DS8201有一部分脑转移的数据还可以,但是在其它肿瘤中呢?我们临床中发现很多病人是颅内进展导致治疗失败的,这个是在临床中必须要解决的问题。
● 疗效预测标志物迷雾重重
Nectin-4要不要测?Trop-2要不要测?既然都是高度过表达还有测的必要吗?现在临床上有些采用 CT-DNA做预测,而不是用Biomarker,空间异质性做科研可以,但不可能用于临床,所以我们现在还没有很好的标志物来选择病人。
● 挥之不去的毒性阴影
6.4mg的DS8201在肺癌中出现26%的间质性肺炎,5.4mg的DS8201在肺癌中也有近20%的间质性肺炎,一旦发生2级及以上间质性肺炎就要使用激素,这会影响后续治疗效果,而且间质性肺炎和免疫的间质性肺炎是不一样的,我们很难去挑战它,这个是临床中的体会。只有明确了机制才有对应的策略。
临床医生选药的时候第一位考虑的是安全性。中国的临床医生不会选择高毒高效的药物,低毒高效的药物才是我们的优选,从毒素的角度来讲,被停掉的ADC大部分是MMAE,大家以后开发这类毒素的时候要特别小心一点。
● 联合治疗,何去何从?
联合PARPi?但是PARPi有风险,因为它本身对血小板下降比较敏感,ADC联合之后会造成血液系统毒性比较大;联合免疫?免疫会造成免疫相关性肺炎,会不会两个肺炎叠加,目前我们入组了一部分病人反应还好,但是样本量大了会不会有毒性的问题;联合TKI?我们也不知道,似乎感觉不能太高的剂量。
● 未来我们的ADC怎样排兵布阵?
如果Trop2在乳腺癌上也可以,HER2在乳腺癌上也可以,两个是不是可以一块用?还是先用谁后用谁?这是一个问题。
● 耐药机制-迈不过去的坎
ADC结构的任一组分发生异常或在周期性治疗压力下都会导致耐药性的产生。机制比较复杂,可能包括:
a)靶点抗原下调、缺失或抗原基因突变;
b)内化途径的缺失;
c)溶酶体蛋白水解功能降低;
d)溶酶体转运蛋白突变;
e)细胞周期停滞;
f)药物外排转运蛋白表达异常;
g)下游信号通路被激活;
h)凋亡失调等等。
03 失败ADC的特点
● 毒性问题
a)靶向非肿瘤细胞的毒性问题;
b)外源性抗原表达太高,使得生物暴露度高,没有足够的抗体结合,因此必须使用非常高效力的有效载荷而导致的毒性;
c)导致有效载荷在非肿瘤区域释放的不稳定Linker;
d)可能是由于ADC胞饮作用而导致的非靶向毒性;
e)有效载荷代谢转化为毒性更大的代谢物。
● 疗效问题
a)低肿瘤靶抗原密度和/或被停用ADC的内化特性差。
b)有效载荷效能不足。
c)异源DAR ADC产品导致有效载荷剂量达不到最佳剂量。
d)肿瘤外有效载荷释放和/或肿瘤内药物释放不完全。
e)由于PK特性差,ADC清除迅速。
f)未能证明疗效优于标准治疗。
g)肿瘤内药物外排转运蛋白升高介导的多药耐药性。
● 商业考虑
目前ADC药物研发集中在成熟靶点,主要是已有上市 ADC药物或者已在其他疗法中得到验证的靶点。其中,上市药物数量最多同时在研药物数量最多的是HER2靶点,在如此内卷的情况下,扎堆的HER2最终能不能上市,商业回报如何,都是很重要的问题。
结语
未来,ADC的设计已经不局限于单抗,以及化疗药物,而是采用不同的组合模式。例如结合双特异性抗体或双重不同化疗药物载荷的ADC,进一步提高抗肿瘤活性;探索免疫刺激分子结合型ADC,以诱导靶向抗肿瘤免疫反应;此外放射性核素结合型ADC的早期临床试验正在进行中,旨在选择性传递放射性有效载荷。
积极拓展靶点选择,寻求差异化发展,是ADC药物研发的必经之路。
主要参考文献
[1] Williams, K. J. Journal of the Royal Society of Medicine 102.8 (2009): 343-348.
[2]Chau CH, et al. Lancet. 2019 Aug 31;394(10200)793-804
[3]Nakada T, et al. Chem Pharm Bull (Tokyo). 2019;67(3):173-185
[4]Trail PA, et al. Pharmacol Ther. 2018;181:126-142
[5]Nakada T, et al. Chem Pharm Bull (Tokyo). 2019;67:173-185;
[6]Ogitani Y, et al. Cancer Sci. 2016;107:1039-1046
[7]Yasushi Goto , MD , PHD , et. al. 2023ASCO oral 9004
[8] Cancer Discov. 2022 Jan;12(1):74-89.
[9] Paolo Tarantino,et al. JAMA Oncol 2021;Kazuyoshi Kumagai Cancer Science 2020
[10] Koichi Goto et al. ESMO 2022
[11]Bob T. Li et al.Trastuzumab Deruxtecan in HER2-Mutant Non–Small-Cell Lung Cancer. NEJM, 2021,
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..