今天,Zealand Pharma宣布向美国FDA递交其长效胰高血糖素样肽-2(GLP-2)类似物glepaglutide的新药申请(NDA),用于依赖肠外营养支持(PS)的短肠综合征(SBS)成人患者的治疗。
该递交主要是基于随机双盲关键3期试验EASE-1的结果。该试验在106例每周至少3天依赖肠外支持的SBS肠衰竭患者中,评估皮下给药10 mg glepaglutide与安慰剂相比的安全性和疗效。分析显示,与安慰剂相比,每周两次glepaglutide给药在第24周显著降低患者每周PS所需总液体体积(P=0.0039)。第24周时,每周两次接受glepaglutide治疗患者的PS液体体积较基线平均降低5.13公升/周。安慰剂治疗仅导致所需PS液体体积降低2.85公升/周。对于接受每周两次glepaglutide治疗的患者,14%的患者(n=5)实现不再需要PS辅助治疗,而安慰剂治疗患者均不能停用PS。
▲健康个体(左)与SBS患者的胃肠道示意图(图片来源:Zealand Pharma公司官网)
在所有试验中,glepaglutide显示具良好安全性与耐受性。最常报告的不良事件为注射部位反应和胃肠道事件。
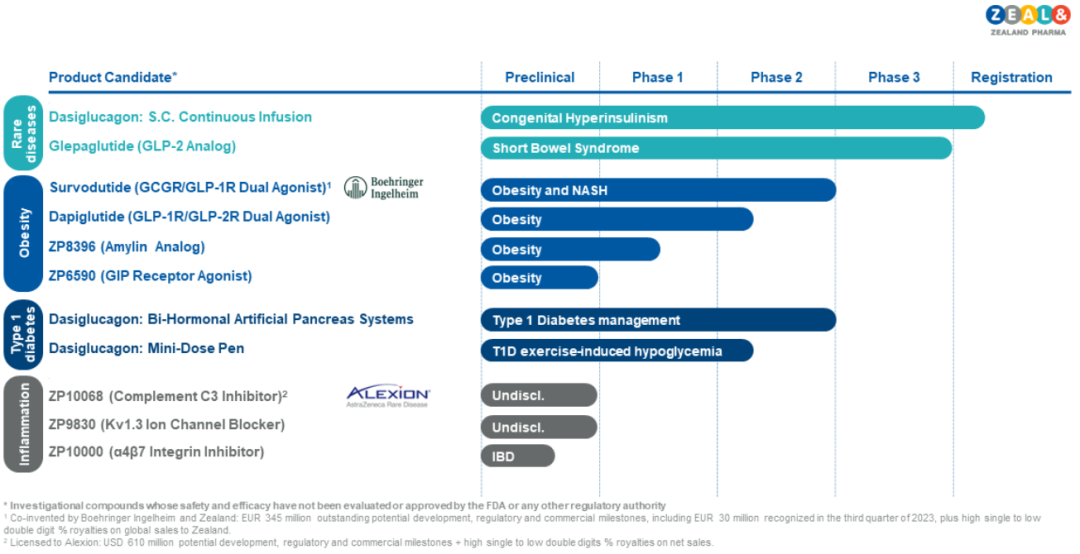
▲Zealand Pharma管线图(图片来源:Zealand Pharma公司官网)
Glepaglutide是一种长效GLP-2类似物,正在开发作为SBS的潜在治疗选择。正在开发的glepaglutide是一种装于自动注射器中的液体产品,设计用于每周两次的皮下给药,旨在减少或消除SBS患者对肠外支持的需求。美国FDA已授予该疗法治疗SBS的孤儿药资格。
参考资料:
[1] Zealand Pharma submits New Drug Application to the US FDA for glepaglutide in short bowel syndrome. Retrieved December 22, 2023 from https://www.globenewswire.com/en/news-release/2023/12/22/2800463/0/en/Zealand-Pharma-submits-New-Drug-Application-to-the-US-FDA-for-glepaglutide-in-short-bowel-syndrome.html
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..