泰诺麦博开发的first-in-class项目TNM002正式发起上市冲刺。
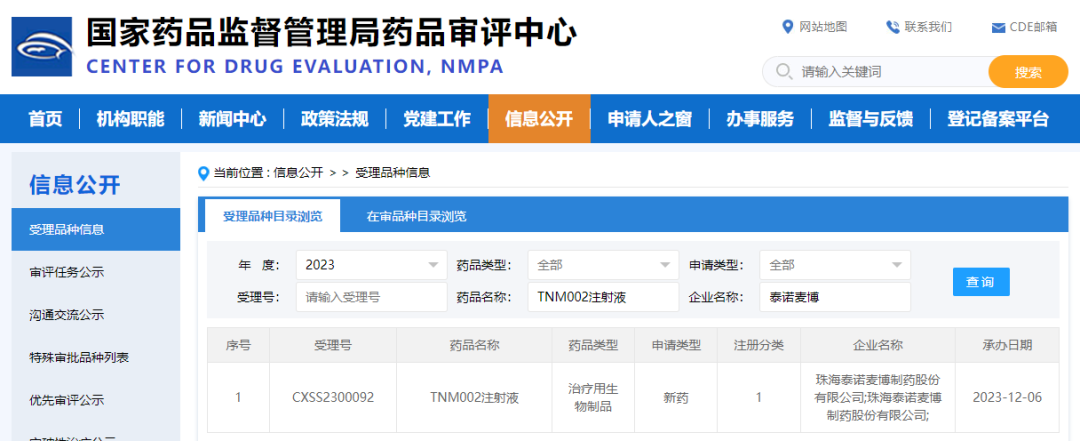
12月6日,泰诺麦博宣布,TNM002的新药上市许可申请获得NMPA正式受理,拟用于破伤风的紧急预防。TNM002的活性成分为重组抗破伤风毒素(TT)天然全人源单克隆抗体,值得注意的是,该药也是破伤风预防领域全球首个走到上市申报阶段的基因重组全人源单抗。
TNM002此前已在中国被纳入突破性治疗品种,并被美国FDA授予快速通道资格。这在一定程度可以窥见,药监部门对于破伤风被动免疫制剂的迫切期待。
1
一个待填补的临床缺口
公共卫生预防领域,破伤风仍旧是需要重视的负担。
相较而言,发达国家的破伤风发病率较低,但在免疫规划项目执行不规范的国家和地区,情况不容乐观。根据公开信息,全世界每年的破伤风发病数量约为100万例,死亡人数为30万到50万例。
目前,我国成年人普遍未进行过系统性的破伤风疫苗注射,仅在儿童时期注射了“百白破”疫苗(含有破伤风类毒素疫苗成分),青少年时期和成年人时期并未再次进行加强接种。注射破伤风被动免疫制剂产品,就成为我国破伤风预防的主要途径。
市面上的破伤风被动免疫制剂,主要可以划分为破伤风抗毒素(TAT)及破伤风人免疫球蛋白(HTIG)。
TAT是由接受TT免疫的马血浆制成的蛋白制剂,其过敏反应发生率高达5%至30%,并且临床使用前需要先进行皮试,皮试呈阳性者需要开展脱敏注射,其过程中仍有14.1%发生过敏反应,1.2%发生过敏性休克。HTIG是采用破伤风疫苗免疫的献血者的血浆分离制备的高效价特异性免疫球蛋白,过敏反应发生率低,这使得HTIG成为多数发达国家和WHO的优选项。
根据WHO的立场,对于外伤后破伤风的预防,优先推荐HTIG进行被动免疫(例如,伤口被污染且伤者未完成免疫程序),这对于破伤风病例的治疗来说也是必不可少的。上个世纪60年代,欧美各国相继研制出HTIG用于临床,并逐渐取代TAT。1991年,WHO将TAT从全球基本推荐用药目录中移除。
弗若斯特沙利文报告显示,全球HTIG生产主要集中于欧洲及北美地区。这很大原因与全球血液制品企业集中于欧美地区有关。另外,由于制备条件较复杂、周期长,也推高了HTIG的使用成本。
2020年,欧洲、北美、中国、日本、东南亚及印度地区销售超2500万支HTIG。东南亚及印度地区本地血浆采浆量可能存在不足,免疫球蛋白产品原料供给存在缺口,产能较弱,因此主要依靠进口血源产品或使用TAT。
而在我国,由于HTIG产量有限,长期处于供不应求状态,TAT仍然为最主要的破伤风被动免疫制剂。2022年中国破伤风被动免疫制剂用量超过6000万支,其中TAT超过5000万支,HTIG约1000万支。
解决前述两种方案在临床应用上的痛点,这便是TNM002的价值定位。泰诺麦博联合创始人、董事长兼CTO廖化新希望,通过尽快推动该药获批上市,改变目前破伤风被动免疫制剂落后现状,为全球破伤风的预防带来全新的用药选择。
2
要做就做真正的差异化
从立项到申报上市,TNM002走过了仅7年多的时间。泰诺麦博为什么选择破伤风被动免疫制剂作为突破口?
据悉,破伤风只是泰诺麦博早期设定的差异化研发方向之一。2016年前后,国内外尚在追逐以PD-1抗体为代表的免疫检查点抑制剂。泰诺麦博的出发点是,与其贸然进入一个红海市场,不如结合自身所长,找到独特的价值。
以TNM002为例,通过肌肉注射给药,该药用于外伤后破伤风的紧急预防。更主要优势体现在以下四个方面:
• 安全性良好:临床试验结果显示TNM002的安全性和耐受性良好,免疫原性低。I~III期临床试验中,TNM002总体不良事件发生率与安慰剂/HTIG相似。
• 疗效良好:TNM002给药后,抗破伤风中和抗体的滴度水平显著高于HTIG组,能快速达到破伤风保护水平并且持续较长的保护时间。III期临床研究结果表明,TNM002注射液在疗效终点上显著优效于目前临床标准治疗250 IU HTIG。
• 可控性强:TNM002是基因重组的单一大分子药物,经过严格的质量控制,可以根据市场需求进行大规模工业化生产,且不存在血液制品存在的潜在的传播血源性传染疾病的风险。
• 可及性高:相对来源于人血浆制品的破伤风特异性免疫球蛋白,TNM002生产周期更短,生产原料不受限,产能易放大,药物可及性更好。泰诺麦博已经完成商业化生产的工厂建设,并获得药品生产许可证,可以满足目前的市场需求。
基于在安全性、有效性和可及性方面与现有治疗手段相比具有明显临床优势,TNM002于2022年3月被CDE纳入突破性治疗品种名单,同年8月被FDA授予快速通道资格。
全球首款获批上市的TT全人源单抗新药有望花落泰诺麦博。按照国内现有政策,在NDA阶段,TNM002可适用优先审评程序,技术审评、核查检验和药品通用名称核准程序都予以优先安排,预期将大大加快TNM002的上市进程。
TNM002只是泰诺麦博的一个开始。利用HitmAb®技术平台高效的筛选能力,泰诺麦博正在围绕感染性疾病、自身免疫性疾病、疼痛类疾病等疾病领域,挖掘具备高度差异化的候选产品。
今年10月,泰诺麦博自主研发的1类抗体新药TNM009注射液(抗神经生长因子单抗)和TNM005注射液(抗水痘-带状疱疹病毒单抗)分别在中国和美国顺利完成首例受试者入组及给药,正式启动I期临床试验。
除了TNM002,另一款接近上市申报的产品还有重组抗RSV全人源单克隆抗体TNM001,该药目前已经在中国进入大型临床研究阶段。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..