药品注册,是国家食品药品监督管理局依照《药品管理法》的规定,根据药品注册申请人的申请,对拟上市销售药品的安全性、有效性、质量可控性等进行审查,并决定是否同意其申请的审批过程。在药品研制、生产、流通、使用的全过程监管中,药品注册管理是从源头上对药品安全性和有效性实施监管的重要手段,其根本目的是通过科学评价,保证上市药品安全有效,保障和促进公众健康。
1 2010年药品注册管理的重要举措
2010年,药品注册管理工作继续践行科学监管理念,紧紧围绕“质量和效率”这个中心,以风险效益评估和风险管理为核心,坚持“规范审批、公开透明、鼓励创新”的原则,全面推进体制机制改革和法制建设,强化学药品物研究全程监管,进一步推进审评审批公开公平,提高审评审批效率,较好地履行了《药品管理法》赋予的职责。
1.1 完善药品注册管理法规体系
一是发布了《药物临床试验伦理审查工作指导原则》,规范和指导伦理委员会的药物临床试验伦理审查工作,加强药物临床试验的质量管理和对受试者的保护,提高药物临床试验伦理审查工作质量。继续开展《药用原辅材料登记备案管理规定》、《药品标准管理办法》、《药物临床试验生物样本分析实验室管理规定》、《药物Ⅰ期临床试验管理指导原则》、《药物临床试验中严重不良事件报告与监测管理规定》及天然药物注册技术要求等法规和规范性文件的研究起草工作。
二是加快药品研究技术指导原则体系建设。成立了人用药物注册技术要求国际协调会(ICH)中国研究小组,对国际标准和技术规范进行深入研究。完成216个国外药品研究指导原则的翻译,其中150个拟转化实施的指导原则已对外征求意见,31个指导原则根据征求意见作了进一步修订,《药物致癌试验必要性的技术指导原则》正式对外发布执行。这些指导原则的建立,使得我国药品注册审评更加科学、规范,也将指导和促进我国新药研发向国际水平看齐。
1.2 确保药品注册审评科学、公正、公开
一是构建了已上市药品、药用辅料、溶出度测定方法等数据库,使药品技术审评建立在科学、量化的基础上。二是以仿制药为切入点,制定了化学药品仿制药电子申报资料格式,启动了电子申报,提高审评审批效率。三是通过重大专项专题会、创新品种沟通交流会、专家咨询会议,以及第三方验证、专家票决等方式,保证技术审评工作的科学性和公正性。四是进一步严格技术审评标准。对于高风险的疫苗、血液制品,坚持审评原则与国际接轨,严格技术审评,保证此类品种质量;对于需长期使用的新药,增加致癌性试验要求,确保用药安全;严格抗生素品种的立题审查及技术要求。五是继续加大信息公开力度。公开审评报告,使申报单位全面了解审评过程和审评决策依据;通过咨询日、开放日、主任信箱、网上信息反馈等多种形式不断加强与社会各界的沟通交流,促进审评工作的公开透明,逐步实现“阳光审评”。
1.3 加强中药、民族药的监管
一是会同卫生部、国家民委及国家中医药管理局共同发布了《全国民族医药近期重点工作实施方案(2010-2012年)》,强调要充分发挥民族医药在少数民族地区防病治病中的积极作用,加强对民族药的监督管理,保障民族地区广大人民群众用药安全。二是会同卫生部、国家中医药管理局等联合发布了《关于加强医疗机构中药制剂管理的意见》,要求发挥医疗机构中药制剂在中医临床诊疗中的积极作用,进一步促进医疗机构中药制剂科学、健康发展。三是贯彻落实国务院《关于扶持和促进中医药事业发展的若干意见》的要求,开展了中药民族药监管现状调研,进一步厘清促进中医药事业健康发展的思路、步骤和措施。
1.4 加强药品研究过程的监督管理
一是加强和完善药品注册现场核查。各省(区、市)全年累积派出几百个工作组、近3000人次,开展了药品注册现场检查,为药品技术审评工作提供了有力的保障。通过问卷调查和实地调研,对近几年药品注册现场核查工作进行了总结和分析,细化了现场检查的要点及相关格式要求。
二是开展GLP/GCP认证工作。2010年,共受理15家药物研发机构的GLP(药物非临床研究质量管理规范)认证申请、48家医疗机构的GCP(药物临床试验质量管理规范)认证申请,派出80个检查组、354人次,对129家机构开展了GLP或GCP认证检查,分别有10家和38家机构通过了GLP和GCP认证。
三是开展药物临床试验电子监管试点。建立了药物临床试验信息化管理系统,并在天津6家医院开展了药物临床试验电子监管试点。通过开展临床试验电子监管,规范了药物临床研究行为,提高了临床试验监管效率,有效地解决了临床试验过程监管缺失问题。
四是开展了药品注册申请人管理制度、药物研究机构分级分类管理模式及药品研究监管信息系统建设等专题研究工作,探索药品研究监管的新模式。
2 2010年药品批准生产上市情况
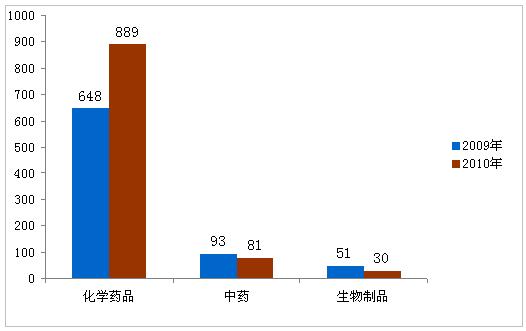
2010年,共批准药品注册申请1000件。其中批准境内药品注册申请886件,批准进口114件。批准上市药品中,化学药品数量仍居首位,占全年批准上市药品的88.9%,其次为中药,生物制品最少。与2009年相比较,2010年批准总数量增加26.2%,主要是由于化学药品仿制药批准数量的增加。
表1:2010年批准的药品情况
| 注册分类 | 新药 | 改剂型 | 仿制药 | 进口药 | 合计 |
| 化学药品 | 103 | 51 | 640 | 95 | 889 |
| 中 药 | 12 | 59 | 9 | 1 | 81 |
| 生物制品 | 12 | 18 | 30 | ||
| 合 计 | 1000 | ||||
注:1. 表中数据以受理号计,受理号系申请人提出的一件申请事项的编号。对各申请企业的原料药、制剂、制剂不同规格分别予以编号。
2. 表中新药系根据《药品注册管理办法》规定按照新药管理的药品。化学药品新药包括化学药品注册分类1-4,中药新药包括中药、天然药物注册分类1-7。
3. 表中化学药品改剂型为化学药品注册分类5,中药改剂型为中药、天然药物注册分类8。
4. 表中化学药品仿制药为化学药品注册分类6,中药仿制药为中药、天然药物注册分类9。
5. 生物制品不进行分类。
图1:2009年与2010年批准的药品对比
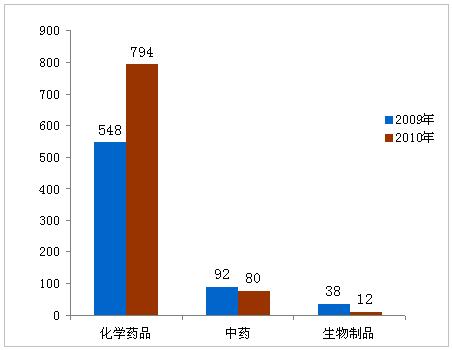
在886件境内药品注册申请中,化学药品794件,中药80件,生物制品12件。新药有124件,占14%;改剂型111件,占13%;仿制药651件,占73%。
表2:境内药品化合物(处方)和受理号的对应关系
| 注册分类 | 新药 | 改剂型 | 仿制药 | 合计 |
| 化学药品 (化合物/受理号) |
69/103 | 37/51 | 291/640 | 397/794 |
| 中 药 (处方/受理号) |
10/12 | 47/59 | 9/9 | 66/80 |
图2:2009年与2010年批准的境内药品对比
注:以受理号计。
表3:2010年批准的化学药品新药分布
| 类别 | 1.5 | 2 | 3.1 | 3.2 | 3.3 | 3.4 | 其他 |
| 数量 | 2 | 1 | 46 | 10 | 5 | 3 | 36 |
| 合计 | 103 | ||||||
注:“其他”指按《药品注册管理办法》(2005年版)分类申报的一、二、三、四类药品。
虽然总体上批准品种的重复现象有所缓解,但仍有部分品种较为集中。本年度批准数量超过10个的品种有:氧、注射用头孢美唑钠、注射用头孢地嗪钠、辛伐他汀片。
批准数量占前10位的品种中,抗生素类占了6席,反映近几年药品生产企业仍然对抗生素品种进行了大量的投入。上述抗生素品种均属于头孢类、沙星类等常规类别,未见新作用类型和新靶点的抗生素。
对已经批准产品按照适应症类别进行分类统计,批准产品适应症前5位的情况如下表:
表4:批准药品的适应症
| 序号 | 适应症 |
| 1 | 抗感染 |
| 2 | 糖尿病 |
| 3 | 心血管 |
| 4 | 呼吸系统 |
| 5 | 抗肿瘤类 |
上述数据表明,2010年,药物研发活动保持良好有序态势,批准上市药品分布于多个治疗领域,为临床医疗提供了更多的药品和治疗手段。
3 批准药物临床研究情况
2010年批准药物临床研究情况如下表:
表5:2010年批准药物临床研究情况
| 注册分类 | 临床试验 | 生物等效性试验 | 合计 |
| 化学药品 | 600 | 180 | 780 |
| 中 药 | 55 | / | 55 |
| 生物制品 | 81 | / | 81 |
| 总 计 | 916 | ||
注:以受理号计。
与2009年相比,2010年批准进入临床研究的化学药品和生物制品均有所增加,批准进入临床研究的药物总数也有所增加。
表6:2009年与2010年批准药物临床研究概况比较
| 注册分类 | 2009年 | 2010年 | 2010年与2009年比较 |
| 化学药品 | 627 | 780 | +24% |
| 中 药 | 81 | 55 | -32% |
| 生物制品 | 64 | 81 | +27% |
| 总 计 | 773 | 916 | +18% |
注:以受理号计。
2010年,共批准32个全新化合物进入临床研究,批准了158件国际多中心临床研究申请。
批准进入临床试验的药物,既涵盖在我国疾病谱中占重要位置的常见疾病和多发疾病,如肿瘤、心血管病等的治疗药物,也包括了社会影响度高的一些罕见性疾病的治疗药物。对于符合《药品注册特殊审批管理规定》要求的,按照特殊审批程序开展审评审批,促进药物研究进程。为保护患者权益,对利伐沙班等无充分研究基础、不符合我国治疗领域用药原则的国际多中心临床试验申请,以及生物素化依达肝素等国外临床研究已出现严重不良反应的临床试验申请,均未批准在中国开展临床试验。
4 批准重要治疗领域品种情况
4.1 治疗罕见病的药品
原发性肺动脉高压属于罕见病,疾病发展迅速、预后效果差、可选择药品少,国家食品药品监督管理局高度关注国际药品研发进展及治疗措施,2010年批准了安立生坦进口上市,批准了可溶性鸟苷酸环化酶(sGC)激动剂和长效非前列素类前列环素受体(IP受体)激动剂进入临床试验。
有条件批准了甲磺酸伊马替尼片用于隆突性皮肤纤维肉瘤(DFSP)的治疗。
批准了用于治疗特发性肺纤维化新化合物的国际多中心临床试验,为我国患者尽早获得有效的治疗药物提供了可能。
4.2 预防、治疗及诊断用生物制品
为贯彻国家血液安全策略,配合卫生部血站血筛试点计划的开展,按照“特殊审评程序”,批准了3个国产及2个进口的乙型肝炎病毒(HBV)丙型肝炎病毒(HCV)人类免疫缺陷病毒(HIV-1)核酸检测试剂盒(PCR-荧光法),为今后血站核酸检测工作的顺利开展打下了良好的基础,为输血“窗口期”防止HBV、HCV和HIV感染提供了保障。
近年来,我国手足口病发病率上升,重症病例和死亡病例也呈现增加趋势,儿童健康受到严重威胁,开展疫苗研制是推进国家健康策略的迫切需要。2010年,国家食品药品监督管理局启动特殊审批程序,组织和协调多方专家,对国内3家企业申报的肠道病毒71型(EV71)灭活疫苗进行研制指导、审评论证,使研发有序推进,并批准其进入临床试验。
批准谷赖胰岛素注射液进口,为控制糖尿病患者膳食血糖提供了新的治疗手段。批准了重组人肿瘤坏死因子受体-抗体融合蛋白进口,为中、重度活动性类风湿关节炎患者以及常规治疗无效的重度活动性强直性脊柱炎患者提供了更多的治疗选择。
批准了首家国产聚乙二醇化重组人粒细胞刺激因子注射液生产,用于降低发热性中性粒细胞减少所引起的感染发生率。该品种上市后,患者由一天一次用药,减为一周一次用药,有利于简化治疗方案,提高用药顺应性。
4.3 治疗HIV感染的药品
批准了首家国产拉米夫定片生产。该药品是《中国艾滋病诊疗指南》中抗病毒治疗方案的一线用药,它的批准,可使国内艾滋病患者获得质量相同而价格低廉的治疗药品。
4.4 治疗肿瘤的药品
按照创新药特殊审批程序,采用重大新药创制专项专题审评会形式,对我国自主研发的小分子靶向新药盐酸埃克替尼片进行了技术审评,并批准生产。
批准地拉罗司分散片进口,用于治疗6岁以上β-地中海贫血患者因频繁输血所致慢性铁负载,并将给药方式调整为一天一次,提高临床用药依从性。批准氟维司群注射液进口,用于“晚期乳腺癌内分泌治疗”,为临床芳香化酶抑制剂内分泌治疗失败人群提供了一种新的治疗选择。
批准多个新剂型药物进行临床研究或生产上市,如地西他赛脂质微球注射液、盐酸米托蒽醌脂质体注射液、盐酸多柔比星脂质体注射液等,提高了肿瘤临床治疗效果。
4.5 抗感染类药品
批准了注射用盐酸替加环素进口。该药品具有明显的抗耐药菌优势,是对当前广泛关注的“超级细菌”具有抗菌活性的两种抗生素之一,为我国应对超级细菌提供了选择。
4.6 治疗结核病的药品
批准了按照《中国结核病防治规划实施工作指南》设计的固定剂量的复方制剂乙胺吡嗪利福异烟片Ⅲ、乙胺吡嗪利福异烟片Ⅳ进入临床试验,对于简化病人的治疗,提高用药的顺应性,有效防止耐药性的产生将发挥重要作用。
4.7 治疗精神神经类疾病药品
批准了国内自主研发的丁苯酞氯化钠注射液。该药品的上市,为急性缺血性脑卒中患者提供了一种新的治疗选择。
批准了普瑞巴林胶囊进口,用于治疗疱疹后神经痛。
4.8 中药
在流行性感冒、小儿手足口病等中医药优势治疗领域,批准了热感糖浆、鱼金清解口服液等品种进行临床研究。对改剂型后能够体现出明显临床应用优势的品种,如蠲哮颗粒、消肿镇痛巴布膏剂等批准进入临床研究。
5 注册受理量的趋势和变化
2010年,药品注册申请受理总量共计6294件,与2009年受理量基本相当。其中,新注册申请为3066个,补充申请为3228个。国内注册申请约占受理总量的80%,进口申请约占20%。化学药品注册申请数量占受理总量的80%以上,中药约10%,生物制品约8%。
表7:2010年药品新注册受理情况表
| 注册分类 | 国内申请 | 进口申请 | 小 计 | |
| 新药申请 | 改剂型及仿制药申请 | |||
| 化学药品 | 821 (320) |
1321 (507) |
565 | 2707 |
| 中 药 | 134 | 44 | 4 | 182 |
| 生物制品 | 98 | 79 | 177 | |
| 合 计 | 2418 | 648 | 3066 | |
注:括号内数据为化合物数量,其他以受理号计。
表8:2010年药品补充申请受理情况表
| 注册分类 | 国产补充申请 | 进口补充申请 | 小计 |
| 化学药品 | 1940 | 547 | 2487 |
| 中 药 | 412 | 38 | 450 |
| 生物制品 | 189 | 102 | 291 |
| 合 计 | 2541 | 687 | 3228 |
图3:2009年与2010年药品注册受理情况对比
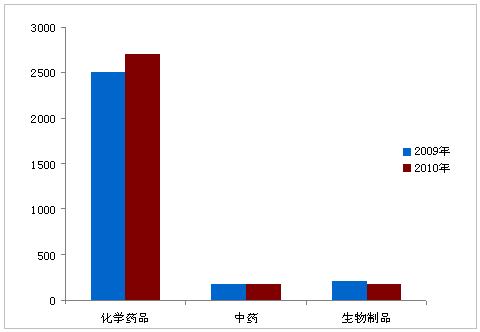
图4:2009年与2010年补充申请受理情况对比
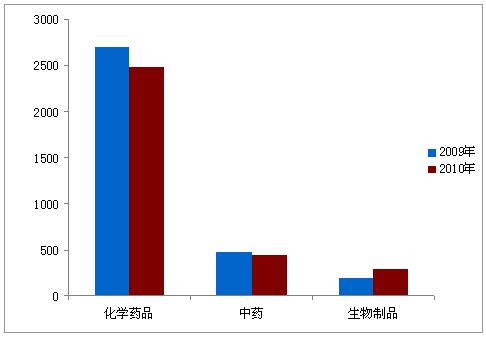
数据表明,申报结构仍然保持合理。国内化学药品新药、改剂型和仿制药申请,分别占化学药品总申报量的38.3%、7.6%、54.1%,与2009年基本持平;中药新药、改剂型、仿制药申请,分别占中药总申报量的75.2%、17.4%、7.4%,与2009年相比,中药新药比例提高约20个百分点。
数据显示,1类新药申报量明显增加,反映了政府企业和社会各界更加注重新药的研制。2010年,受理了6种“替尼”类抗肿瘤、3种抗生素类(培南类,沙星类和头孢类各1种)及3种“福韦”类新药的注册申请,反映出企业对抗肿瘤、抗病毒和抗感染创新药的研发更为关注,投入更多。
6 结语
2011年,国家食品药品监督管理局将根据国家新药创制战略部署,继续优化完善工作程序,探索创新注册审评模式,提高审评质量和效率,严格控制上市药品风险,依法依规开展药品注册审批工作,有效引导药品研发向创新方向发展,努力保障上市药品安全、有效和质量可控,保障和促进人民群众身体健康。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..