从MNC到Biotech,大概没有一家公司不想拥有属于自己的first-in-class药物。
引用FDA的说法,first-in-class指向的是被授予使用全新的、独特的作用机制来探索治疗某种疾病的产品。相应的,该类药物往往具有先发优势,被寄予成为“重磅炸弹”的厚望。
但故事并未总是水到渠成。当下,全球首款KRAS抑制剂Sotorasib和它的开发商安进,便面临关于验证性临床失败的诘问。不过如果说,Sotorasib的争议倒还是有效性数据的不坚实,那么近期另一款首创抗菌药Brexafemme(ibrexafungerp)的遭遇,便有些令人咋舌。
2021年,当Brexafemme获得FDA的批准时,一些分析师预计它的销售峰值将突破10亿美元。但仅仅两年后,Brexafemme走上了一条弯路。
将这款产品成功带向市场的Scynexis最近称,在合作伙伴GSK对Brexafemme制造审查过程中,发现该药片剂的柠檬酸盐可能与非抗菌β-内酰胺药物物质交叉污染,而FDA要求,β-内酰胺药物的生产应独立开来,以避免可能的过敏反应。为此,两家公司“暂时”将Brexafemme撤出市场。
暧昧的是,审查的时间表并未落定。GSK的发言人只是表达了这个过程的持续,而分析师称,Scynexis也许要好几个月来消化此次事件。
对于Scynexis来说,眼前绝非坦途。召回产品的消息一出,该公司当日股价直接下跌30%。尽管暂未收到跟交叉污染有关的不良反应报告,Scynexis出于“慎重考虑”,还是暂停了相关临床研究。甚至,这家Biotech还准备“调整”高管名单——上一次调整是在FDA批准Brexafemme的一年后,Scynexis裁员40%。
为什么first-in-class的故事不好讲了?从每股股价上百美元到如今的个位数徘徊,Scynexis何以至此?Brexafemme背后,是并不容易实现的前沿科学成果与商业化营收的平衡。
1
光明前程
去年3月,一篇发表在Nature Reviews Microbiology的有关抗真菌耐药性文章指出,在全球环境发生深刻变化和高危人群不断扩大的时期,由于对抗菌素耐药性未得到充分认识,侵袭性真菌感染已对公共健康构成重大威胁,甚至变为全球新危机。
事实上,尽管在过去20年中,人们对抗菌药的耐药性及引起的一系列挑战与壁垒进行广泛的讨论,但切实的果实少之又少。临床治疗仍然以多烯类、唑类和棘白菌素类抗真菌药物为主——如何在临床治疗中克服耐药,仍是一个难以逾越的痛点。
一家专注于开发创新疗法以克服、预防难治或耐药性感染的Biotech——Scynexis尝试突围,并从彼时默沙东旗下尚处“襁褓”、后来成功上市的Brexafemme看到希望。
2013年5月,Scynexis从默沙东获得了Brexafemme所有相关技术文件、临床前数据、默沙东进行的7项I期试验的数据以及制剂和原料药。随后一年,默沙东完成了将该药的相关专利转让。
Brexafemme是基于enfumafungin迭代设计的一种新型口服葡聚糖合酶抑制剂,类似于棘白菌素类。相比前三代抗真菌药物,Brexafemme能抑制致病真菌细胞壁的基本成分β-(1,3)葡聚糖,在哺乳动物细胞中不存在脱靶风险。面向更宽泛的抗真菌应用中,Brexafemme给药途径更加灵活,可做成口服及静脉剂型,应用前景广阔。
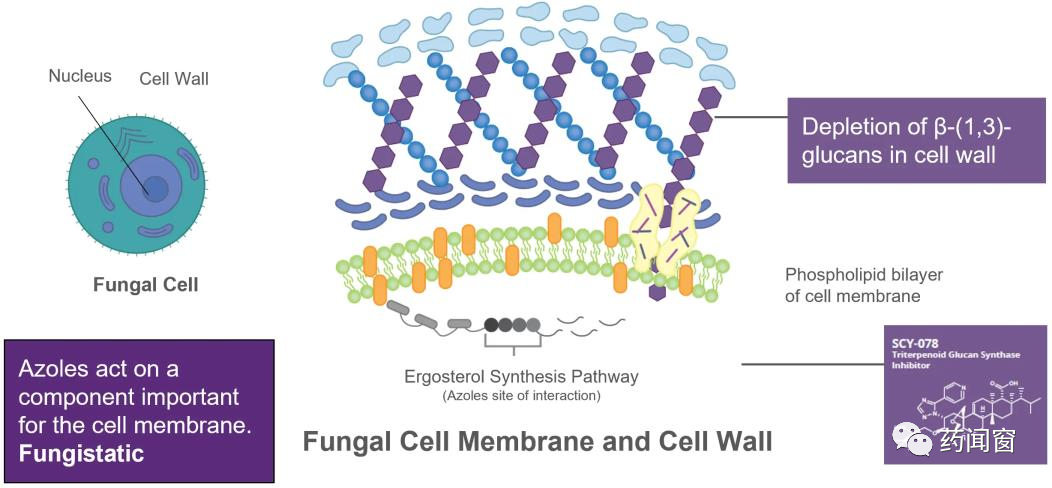
(图源:药闻窗)
凭借独特的作用机制,在VANISH 303、VANISH 306两项治疗外阴阴道念珠菌病(VVC)的III期临床研究中,Brexafemme皆展现了积极的疗效。结果显示,与安慰剂相比,该药到达了研究的主要终点(8-14天CCR)与次要终点(21-29天CCR)。
预防复发酵母菌阴道炎(RVVC)与治疗院内的侵入性真菌感染方面,Brexafemme临床数据也颇具优势。以往CANDLE、FURI、CARES等研究表明,当随访事件为24周时,RVVC患者无复发比例为65.4%(对照组53.1%)。此外,该药已被证明可有效治疗数种真菌感染引起的院内感染,预计将于2024年在美国获批。在安全性方面,Brexafemme的安全性及耐受性良好。

(图源:凯莱英药闻;ORR:客观缓解率)
2021年,Brexafemme终于获得FDA首肯,成功登录美国VVC市场。同年,国内的翰森制药也向这款全球首创的抗真菌剂抛出橄榄枝。
翰森制药与Scynexis签订战略合作协议,以1000万美元首付款及潜在的里程碑金额及销售提成,获得Brexafemme在大中华区(包括香港、澳门及台湾)开发和商业化的独家权益。7月20日,翰森制药向NMPA提交该药用于治疗成人和经期后女性的NDA获受理。
VVC之外,Scynexis也努力开发其他其他市场。2022年12月,Brexafemme获批用于预防复发性RVVC。至此,该药成为第一个获批用于治疗VVC和降低RVVC发病率的口服抗真菌药,前途看似一片光明。
2
绝地求生
与想象不同,这款first-in-class药物给Scynexis带来多少资金回报,反倒走进了更大的不确定性。
从接手到登陆市场,Scynexis在Brexafemme的开发上耗时超过7年,对于默沙东来说或许不算什么,但作为一家Biotech,加之此前手上现金流十分紧张,这个周期稍有不慎足以令其左支右绌。
事实上,Scynexis与默沙东之间签订的原本总额最高达1900万美元付款一推再推。
2020年12月,两者修订协议,取消了首次提交NDA向默沙东支付里程碑的条款,将现金的形式支付取而代之为未来的销售分成。2022年,Scynexis再次与默沙东修改了授权协议,明确推迟了应向后者支付的里程碑付款时间,本应在Scynexis的II期临床试验的付款,同等金额增添到III期临床启动的里程碑付款中。
众所周知,创新药研发投入与回报在周期乃至数额上并不一定对等,对于耐药性高速迭代的抗菌药领域更是如此。
2022年第二季度,Scynexis支出总额高达2290万美元,包括710万美元的研发投入与1580万美元的销售和行政费用,净亏损已超过1300万美元。而Brexafemme上市一年后,商业化表现让市场大跌眼镜——2022年上半年,Brexafemme的营收为200多万美元,仅有预期值的四分之一。
商业化的受挫,令Scynexis不得不有所行动。Scynexis很快宣布进行战略调整,削减相关的营销投入、管理阶层变故连连、大刀阔斧裁员40%行动,甚至包括部分研发岗位,以便将更有限的资源聚焦尚在推进的管线中。同时,Scynexis还试图以license-out的形式,寻找更合适的对象合作。
正当外界担心Scynexis一蹶不振之际,GSK伸出援手,以首付款形式直接向Scynexis“输血”9000万美元。
3月30日,根据与Scynexis达成独家许可协议,GSK引进Brexafemme在美国、欧洲、日本等地区的开发和商业化权益,并拥有Brexafemme的其它衍生产品的优先谈判权。如果顺利,Scynexis还将收到总额为5.3亿美元的额外潜在里程碑付款以及特许权使用费。
随着GSK的加盟,Scynexis不久前披露的2023年半年报显示,在2024年适度支出的情况下,其价值9190万美元的现有现金、现金等效物和2500万美元的开发里程碑付款,可以维持两年以上的正常运营。
然而,此次Brexafemme项目开发的中止,无疑令Scynexis的前途再度堪忧。
目前,GSK正继续与Scynexis一起评估情况,以确定后续步骤。Guggenheim分析师估计,该公司至少还需要几个月才能制定其他改善战略,为市场提供补给并恢复临床试验。
Scynexis的未来没有多少试错成本了。就算GSK不离不弃,其他药企也加速跑进抗菌市场,抢占山头。
3
后有追兵
VVC是一种育龄女性的常见病和多发病。根据中国2012年VVC诊治规范分类标准,这种疾病可分为单纯性VVC和复杂性VVC。据悉,约75%的女性一生中都会患一次VVC,但仍有40%-50%会复发。
现阶段,针对VVC治疗,国内外指南均首推硝酸咪康唑,还有几种外用唑类抗真菌药物(克霉唑、咪康唑等)。相关临床显示,该类药在患者中有高达55%的治愈率。
遗憾的是,抗真菌药物的耐药性如影随形——即使最有代表性的药物氟康唑,在对重度VVC的耐药率也可以高达20%-30%。此外,对于孕期患者,氟康唑治疗存在局限性。以往研究表明,该药或对胎儿造成潜在的伤害。
临床需求决定药物价值。有行研机构认为,全球VVC市场还是一片蓝海,其理论市场规模约在8至10亿美元之间。
即使有Brexafemme这样的商业化表现平平的案例,仍不乏有冲线者。
Mycovia抓住了这个机会。2022年,该公司用于治疗RVVC领域的药物Vivjoa获FDA批准。作为一种唑类抗真菌药物,Vivjoa主要通过抑制真菌细胞壁完整性所需的真菌CYP51起效。
更早些时候,一直在探索感染疾病领域的恒瑞医药,也注意到了Vivjoa的“颠覆性”。2019年,恒瑞医药以超1亿美元的研发付款和里程碑付款,从Mycovia引进Vivjoa(奥特康唑)在中国的临床开发、注册、生产和市场销售的独家权益。今年6月,奥特康唑成功被NMPA批准,用于治疗重度VVC。
面对硝酸咪康唑“霸榜”国内抗真菌市场之久,如何短时间内改变临床用药习惯,是奥特康唑需要应对的挑战。
恒瑞医药打算从“硬实力”出发。在一项名为SHR8008-302 III期研究中,奥特康唑组的VVC痊愈率较氟康唑组提高21%。此外,奥特康唑组28天的真菌学治愈率较氟康唑组提高23%;临床治愈率较氟康唑组高出15%。恒瑞医药还开展了有关SHR8008治疗RVVC的本土多中心III期临床研究,正在国内24家研究中心开展,拟入组196名受试者。
但只盯着VVC,盘子毕竟有限,更多公司尝试将目标放在不断扩容的抗菌市场中。根据弗若斯特沙利文数据预计,未来十年中国抗菌药市场将稳定在千亿级别。
当抗菌逐渐成为一场新的治疗革命,势必有更多MNC和Biotech身影涌现。
本土药企中,另一家聚焦抗多重耐药抗菌药领域的盟科药业,也正推进出海。2021年6月,盟科药业核心产品康替唑胺在中国获批上市,用于治疗金黄色葡萄球菌(甲氧西林敏感和耐药的菌株)、化脓性链球菌或无乳链球菌引起的复杂性皮肤和软组织感染。目前,康替唑胺正在进行全球多中心的III期临床试验。
在跟Scynexis达成许可协议时,GSK的首席商务官Luke Miels的期待言犹在耳。他相信,GSK可以利用自身商业影响力,将Brexafemme这款首创抗菌药的年销售额提高到5亿美元以上。
如今看来,这个目标倘若不至于破产,恐怕也要被延后一大截。留给Scynexis的问题是,抗菌市场会等待它的下一次转身吗?
参考资料:
1.创新药系列之三:Ibrexafungerp;药闻窗
2.Tackling the emerging threat of antifungal resistance to human health;Nature Reviews Microbiology
3.Scynexis to recall GSK-partnered antifungal on cross contamination risk;REUTERS
4.洞见研报
5.各公司官网
6.GSK manufacturing review prompts Scynexis to pull Brexafemme, halt trials over contamination concerns;fiercepharma
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..