7月13日,CDE官网显示,瓴路药业/ADC Therapeutics在研的靶向CD19抗体偶联药物(ADC)注射用泰朗妥昔单抗(Loncastuximab tesirine)上市申请获得受理,适应症单药治疗复发/难治性弥漫性大B细胞淋巴瘤(R/R DLBCL)。泰朗妥昔单抗是国内首个申报上市的靶向CD19的ADC药物,同时也是首款获得美国FDA批准的靶向CD19的抗体偶联药物(ADC),瓴路药业与ADC Therapeutics成立的合资公司瓴路爱迪思拥有该药在大中华区和新加坡的权益。
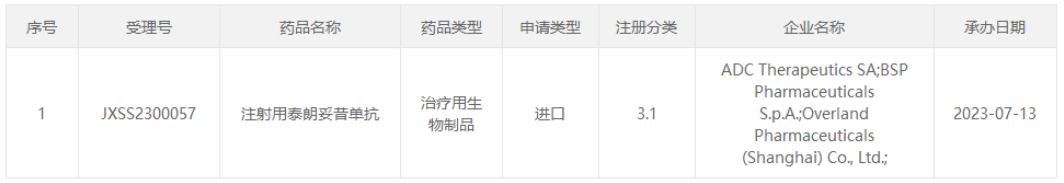
来源:CDE官网
泰朗妥昔单抗由ADC Therapeutics研发,是一款针对CD19靶点将抗 CD19 单克隆抗体与小分子药物SG3199(吡咯并苯二氮杂䓬二聚体(PBD)细胞毒素)偶联在一起的抗体偶联药物。PBD 进入细胞后通过与CD19结合,在肿瘤细胞内释放出的SG3199与DNA结合,使得DNA双链产生交联,阻断DNA链的分离,破坏DNA的复制,以致肿瘤细胞死亡,这项技术源于Spirogen Limited的PBD抗体药物偶联技术。在临床试验中,Lonca在广泛的r/r DLBCL、套细胞淋巴瘤和滤泡性淋巴瘤患者中显示出显著的单药临床活性。
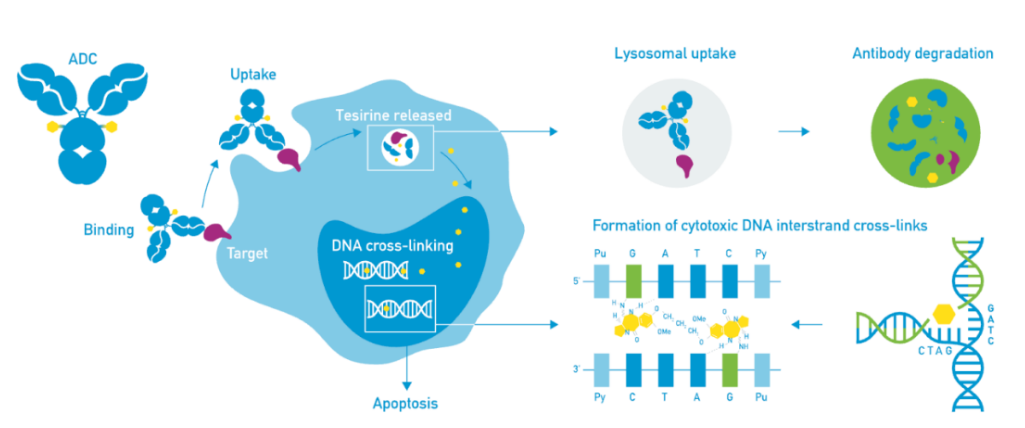
朗妥昔单抗作用机制
图片来源:ADC Therapeutics官网
2021年4月23日,loncastuximab tesirine获得了FDA的加速批准,用于治疗至少接受过2线及以上系统治疗的复发或难治性弥漫大B细胞淋巴瘤(r/r DLBCL)成年患者,包括非特定类型的DLBCL、低分化淋巴瘤转化的DLBCL和高级别B细胞淋巴瘤。Lonca也成为全球首个、也是迄今唯一一款获批上市的CD19-ADC药物。FDA批准Lonca上市的依据为单臂2期临床试验LOTIS-2的临床数据,该临床试验用于治疗先前接受过两次或更多次全身性治疗的145名成年r/ rDLBCL患者。试验结果显示,Lonca单药治疗总缓解率(ORR)为48.3%(70/145位患者),其中完全缓解(CR)率为24.1%(35/145位患者)和部分缓解(PR)率为24.1 %(35/145患者)。患者的中位反应时间为10.3个月,其中70位反应者的中位反应持续时间(mDoR)为1.3个月(包括接受审查的患者)。不良事件方面,由于不涉及T细胞激活,无细胞因子风暴(CRS)和神经毒性(NT),主要毒性为血液毒 性。2022年12月,Lonca又获得欧洲药品管理局(EMA)的附条件批准。
目前正在进行几项LOTIS系列试验,评估针对DLBCL和B-NHL的疗效和安全性以及联合用药相关情况。

2022年7月11日,在LOTIS-5验证性第三阶段全球临床试验中,首例患者在中国接受了朗妥昔单抗联合利妥昔单抗的治疗,该试验是全球首个评估Lonca+R联合方案(同时靶向CD19和CD20)治疗2L+R/RDLBCL患者的多中心随机对照III期临床试验。前期临床前实验结果显示Lonca联合利妥昔单抗通过同时靶向CD19和CD20能够高效杀伤DLBCL细胞,显示了协同效应。
截止目前,已有7款ADC药物在全球范围内获批用于治疗血液恶性肿瘤。其中,中国获批3款,分别是武田的维布妥昔单抗(brentuximab vedotin)、辉瑞的奥加伊妥珠单抗(inotuzumab ozogamicin)和罗氏的维博妥珠单抗(polatuzumab vedotin)。而在DLBCL领域仅有两款ADC药物获批治疗R/R DLBCL,分别是Loncastuximab tesirine(Lonca)和Polatuzumab vedotin(Pola)。罗氏的靶向CD79b ADC维博妥珠单抗(polatuzumab vedotin)已于今年1月在中国获批上市,批准了两项适应症,分别为:联合利妥昔单抗、环磷酰胺、多柔比星和泼尼松,适用于治疗既往未经治疗的弥漫性大B细胞淋巴瘤(DLBCL)成人患者;联合苯达莫司汀和利妥昔单抗,用于不适合接受造血干细胞移植的复发或难治性DLBCL(R/R DLBCL)成人患者。
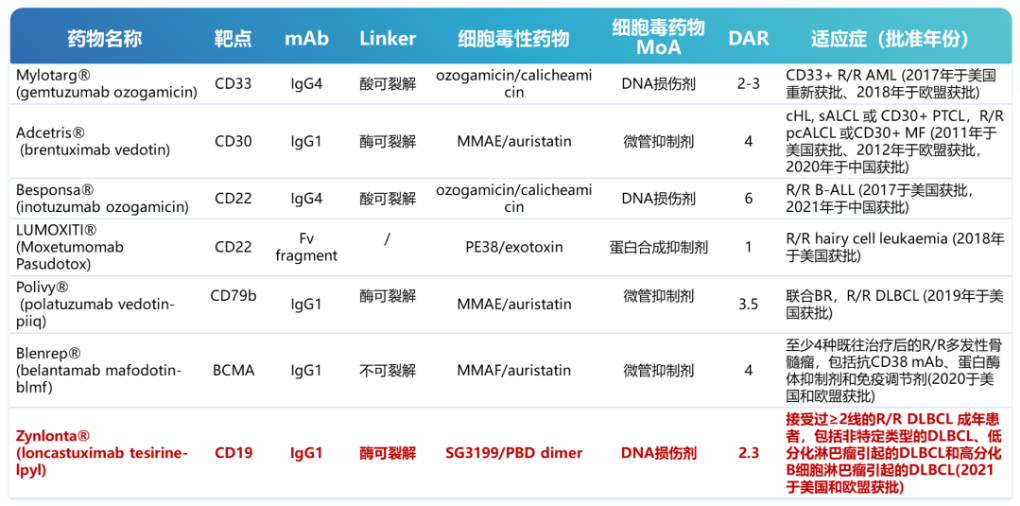
目前血液肿瘤领域已获批上市的ADC药物列表
图片来源:血液肿瘤资讯
目前Lonca联合Pola(同时靶向CD19和CD79b)治疗淋巴瘤的早期探索也在进行中,前期临床前研究结果显示Lonca联合Polatuzumab vedotin能够协同杀伤淋巴瘤细胞,而且小鼠体内试验显示两者联合方案可耐受。基于前期试验基础,研究者启动了LOTIS-7研究(NCT04970901),这是一项Ib期的开发标签、多中心、多臂临床研究,目前开放了Arm1,也就是Lonca+Pola治疗3线及以上的复发难治B细胞非霍奇金淋巴瘤的队列入组,研究分为2个阶段,第一个阶段为剂量递增:Pola为1.8mg/kg,Lonca进行剂量爬坡(90 μg/kg-150 μg/kg),每三周为一个疗程,至多治疗一年,确定RP2D后进入第二个阶段-剂量扩展阶段。目前LOTIS-7正在积极入组中,2022年6月完成了第一例患者用药,期待后续进一步的临床研究数据在国际大会上的报道。
参考来源
1.CDE官网
2.ADC Therapeutics官网
3.businesswire丨ADC Therapeutics Submits Biologics License Application to the U.S. Food and Drug Administration for Loncastuximab Tesirine for Treatment of Relapsed or Refractory Diffuse Large B-cell Lymphoma;Sep 21, 2020
4.Biospace丨ADC Therapeutics Reports Second Quarter 2020 Financial Results and Provides Recent Business Highlights;Aug 18, 2020
5.Lee A. Loncastuximab tesirine: first approval. Drugs 2021;81(10):1229–33.
6.Deeks ED. Polatuzumab vedotin: first global approval. Drugs 2019;79(13):1467–75.
7.Sachini N, Jabeen A, van Berkel PH, Zammarchi F. Combination of Loncastuximab Tesirine and Polatuzumab Vedotin Shows Increased Anti-Tumor Activity in Pre-Clinical Models of Non-Hodgkin Lymphoma. Blood 2021;138:2273.
8.Hess BT, Collins GP, Solh M, et al. A Phase 1b Open-Label Study of Loncastuximab Tesirine in Combination with Other Anticancer Agents in Patients with Relapsed or Refractory (R/R) B-Cell Non-Hodgkin Lymphoma (LOTIS-7). Blood 2022;140(Supplement 1):12079–80.
认真落实巡视组反馈意见,进一步规范协
按照四川省市场监督管理局党组巡视..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于召开会长办公会的通知
各会长、副会长单位: 根据四川..四川省医药保化品质量管理协会组织召开
2025版《中国药典》将于2025年10月..四川省医药保化品质量管理协会召开第七
四川省医药保化品质量管理协会第七..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..学习传达中央八项规定精神专题会议
2025年4月22日,协会党支部组织召..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..