近日,Sarepta Therapeutics与罗氏(Roche)联合开发的基因疗法Elevidys获得美国FDA加速批准上市,成为首个用于治疗杜氏肌营养不良4-5岁患者的一次性基因疗法。这款重磅基因疗法的获批,让大家的目光再次聚焦到了发展迅速、潜力巨大的细胞和基因疗法领域。
据不完全统计,6月全球细胞和基因疗法领域迎来至少37项研发进展。除了Elevidys获批上市之外,还有2款疗法的生物制品许可申请(BLA)获FDA受理,并获优先审评资格;2款疗法获FDA授予快速通道资格或孤儿药资格;还有数款疗法取得临床试验积极进展。本文将节选部分重要研发进展做简要介绍,供读者参阅。
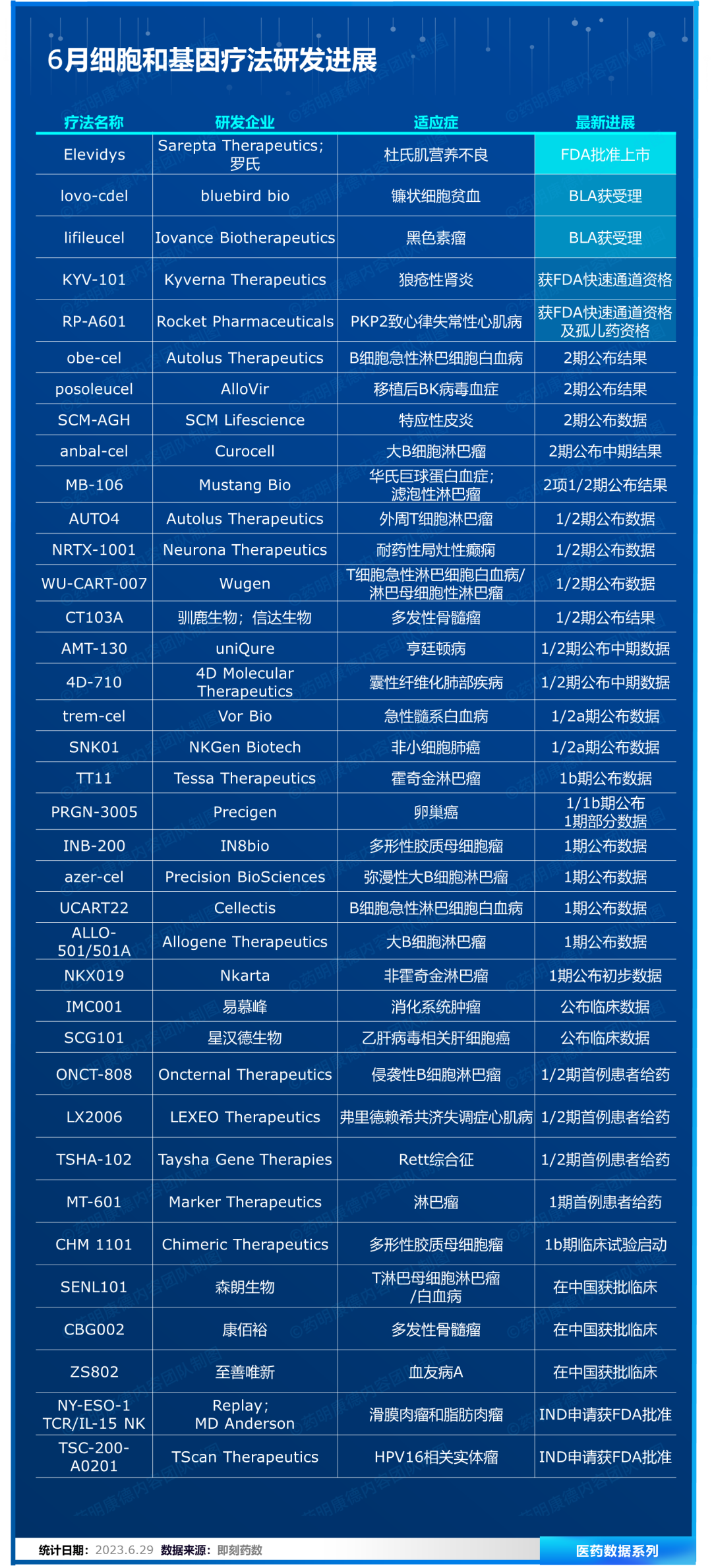
基因疗法Elevidys获FDA批准上市
6月23日,Sarepta Therapeutics公司宣布,其与罗氏联合开发的基因疗法Elevidys(SRP-9001)获得美国FDA加速批准上市,成为首个用于治疗杜氏肌营养不良(DMD)4-5岁患者的一次性基因疗法。这些患者携带经验证的DMD基因突变,且并没有预先存在阻止该疗法作用的医学原因。根据行业媒体Endpoints的报道,Elevidys亦是首个通过加速批准上市的体内基因疗法。
Elevidys是一款重组基因疗法,将表达微抗肌萎缩蛋白(micro-dystrophin)的转基因包装在AAV病毒载体中,通过单次静脉注射,使得患者肌肉生成具有部分抗肌萎缩蛋白功能的重组蛋白,可以对携带任何类型DMD致病基因变异的患者生效。罗氏在2019年与Sarepta达成28.5亿美元的研发合作,共同开发这一基因疗法。
基因疗法lovo-cel获FDA优先审评
6月22日,bluebird bio宣布FDA已接受其治疗镰状细胞贫血(SCD)患者的lovotibeglogene autotemcel(lovo-cel)基因疗法的生物制品许可申请(BLA),并授予优先审评资格。FDA预计在2023年12月20日前完成审查。根据新闻稿,此BLA的递交是基于迄今最大型、完整的SCD基因疗法临床项目的结果。
Lovo-cel是一种在研、用于治疗SCD的一次性基因疗法,其设计目的是将改良形式的β-珠蛋白基因(βA-T87Q珠蛋白基因)的功能拷贝添加到患者自身的造血干细胞(HSCs)中。一旦患者具有βA-T87Q珠蛋白的基因,他们的红细胞可以产生能够抵抗血红细胞镰刀化的血红蛋白(HbAT87Q),从而降低HbS的比例,目标是减少镰状红细胞、溶血和其他并发症。FDA此前已经授予lovo-cel孤儿药资格、快速通道资格、再生医学先进疗法认定(RMAT)和罕见儿科疾病认定。
TIL细胞疗法lifileucel获FDA优先审评
6月1日,Iovance Biotherapeutics宣布,美国FDA已接受旗下细胞疗法lifileucel用于晚期黑色素瘤患者的生物制品许可申请(BLA),并授予其优先审评。PDUFA日期被设定为2023年11月25日,FDA目前并不计划召开咨询委员会会议来讨论该申请。经过初步审评,目前尚未发现任何潜在的审评问题。
Lifileucel是基于患者自身的肿瘤浸润淋巴细胞(TIL)构建的细胞疗法,通过从患者体内获取肿瘤组织并且提取TIL,然后在体外使用IL-2细胞因子以刺激TIL的扩增。这一体外刺激手段不但增加了TIL的数量,还能激活TIL的抗肿瘤能力。Lifileucel拟用于既往抗PD-1/L1治疗和靶向治疗(如适用)期间或之后发生病情进展的晚期黑色素瘤患者,目前该治疗领域内尚无FDA批准的疗法。FDA曾授予lifileucel治疗晚期黑色素瘤的再生医学先进疗法(RMAT)认定。
CAR-T细胞疗法KYV-101获FDA快速通道资格
6月2日,Kyverna Therapeutics宣布美国FDA已授予KYV-101用于治疗难治性狼疮性肾炎(LN)患者的快速通道资格。KYV-101是一种新型的抗CD19嵌合抗原受体T细胞(CAR-T)疗法,旨在耗尽自身免疫性疾病患者的B细胞,包括自身反应性B细胞。Kyverna在美国开展的KYV-101的1期开放标签、多中心临床试验正在美国多个研究中心积极招募患者。Kyverna还向德国Paul Ehrlich研究所(PEI)提交了其首个欧盟(EU)临床试验申请(CTA),用于KYV-101治疗LN的平行1/2期临床试验。
基因疗法RP-A601获FDA快速通道资格及孤儿药资格
6月8日,Rocket Pharmaceuticals宣布,美国FDA已授予其基因疗法RP-A601快速通道资格和孤儿药资格,RP-A601是该公司治疗plakophilin-2相关致心律失常性心肌病(PKP2-ACM)的基因治疗候选药物。
RP-A601是基于Rocket腺相关病毒(AAV.rh74)的PKP2-ACM基因疗法,PKP2-ACM是一种颠覆性遗传性心脏病,与危及生命的心律失常、心脏结构异常和心源性猝死有关。该公司正在启动一项多中心1期剂量递增试验,该试验将评估RP-A601在至少六例携带埋藏式心脏复律除颤器(ICD)且总体上具有危及生命的心律失常高风险的成年PKP2-ACM患者中的安全性和初步疗效。该研究将评估RP-A601对PKP2心肌蛋白表达、心脏生物标志物、危及生命的室性心律失常和心源性猝死的临床预测因子的影响。
CAR-T细胞疗法azer-cel总缓解率达83%
6月2日,Precision BioSciences发布了其同种异体CAR-T管线中的主要候选疗法azercabtagene zapreleucel(azer-cel)的最新临床进展。Azer-Cel在先前接受过CAR-T细胞治疗后复发的弥漫性大B细胞淋巴瘤(DLBCL)患者中的效果最佳,可达到83%的总缓解率(ORR),超过半数的患者缓解持续时间超过6个月。
Azer-cel是一种靶向CD19的同种异体CAR-T候选疗法,该疗法利用了Precision公司的ARCUS基因组编辑技术对供体来源的T细胞进行修饰,由此所产生的细胞产品可以识别肿瘤细胞表面蛋白CD19——这是多种B细胞癌症中一个重要且经过验证的靶点。
CAR-T细胞疗法obe-cel达到76%完全缓解率
6月3日,Autolus Therapeutics公司在美国临床肿瘤学会(ASCO)年会上,公布了新一代CAR-T细胞疗法obecabtagene autoleucel(obe-cel)在关键性2期临床试验中的最新结果。在接受治疗的94位复发/难治性B细胞急性淋巴细胞白血病(B-ALL)患者中,76%的患者获得完全缓解(CR)或CR伴不完全的血液恢复(CRi)。安全性分析表明,obe-cel表现出潜在“best-in-class”的耐受性,3%(3/94)和7%(7/94)的患者分别出现大于3级的细胞因子释放综合征(CRS)和免疫效应细胞相关的神经毒性综合征(ICANS)。
Obe-cel是一款靶向CD19抗原的自体CAR-T细胞疗法。它旨在克服当前CAR-T细胞疗法在临床活性和安全性方面的局限性。它的独特之处在于,设计的嵌合抗原受体在与CD19结合后具有较快的解离速度(fast off-rate),从而能够尽量减少T细胞的过度激活,在降低毒副作用的同时,不易发生T细胞耗竭,提高CAR-T疗法的持久性。
我们期待细胞和基因疗法领域不断迎来新进展和新突破,为广大患者带来更多安全有效的治疗选择。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..