在医药「寒冬」的冷风呼啸之中,GLP-1 正逆流直上,呈现炙手可热之姿。在包括肥胖在内的全代谢谱系适应症布局加持之下,这类药物已经火出医药圈外。
上周五到今日(6.23 - 6.26),第 83 届美国糖尿病协会(ADA)年会召开。期间,无论是司美格鲁肽 vs 替尔泊肽的双雄之争,还是双靶点乃至三靶点激动剂的涌现,再到小分子 GLP-1R 激动剂的竞逐,都颇多看点。
值得注意的是,GLP-1 赛道前线不光海外巨头,国内企业的身影也逐渐浮现。本次恒瑞等企业开发的双靶点新药都首次放出了临床数据。
本文从肥胖/超重的角度,简略透视 ADA 年会中的 GLP-1 新动态、新格局。
礼来 vs 诺和诺德:
口服药、多靶点的全方位对决
礼来的 GLP-1R/GIPR 双重激动剂替尔泊肽(Tirzepatide,Mounjaro®)是挑动重磅炸弹司美格鲁肽的一匹黑马,在头对头司美格鲁肽成功之后更是名声大噪,几乎是公认峰值年销售额必将超过百亿美元的超级重磅炸弹。
礼来向来肯在关键项目上下重注,同时开多项大 III 期临床,SURMOUNT 系列正是针对肥胖症的关键 III 期临床项目。在本次 ADA 上,礼来公布 III 期临床 SURMOUNT-2 的完整结果,这项临床试验针对 2 型糖尿病患者的肥胖症/超重。
SURMOUNT 系列研究详情概览
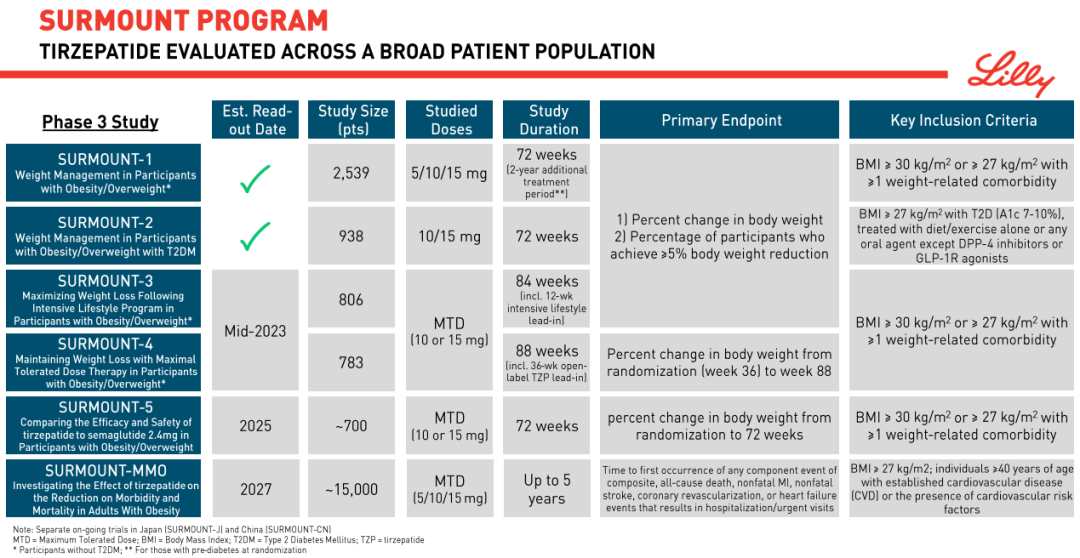
图源:礼来 2023Q1 财报
今年 4 月 28 日,礼来曾公布 SURMOUNT-2 研究的顶线结果。
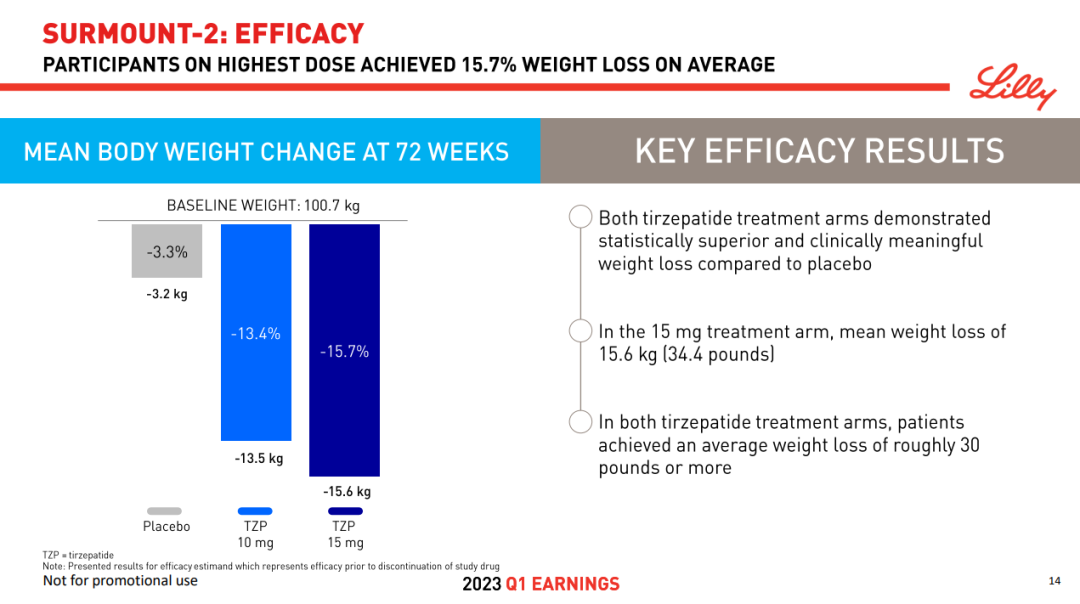
SURMOUNT-2 研究是一项多中心、随机、双盲、安慰剂对照的 III 期临床试验,共纳入 938 例受试者,平均基线体重为 100.7 kg,基线 A1C 为 8.0%。共同主要终点为 Tirzepatide 10 mg 和 15 mg 剂量组在第 72 周时降低体重的百分比效果以及减重 5% 以上的患者比例。
结果显示,与安慰剂相比,10 mg 和 15 mg Tirzepatide 在治疗 72 周时取得了显著的减肥效果。
与安慰剂(3.3%、3.2 kg)相比,10 mg 组患者体重平均减轻了 13.4%(13.5 kg),15 mg 组平均体重减轻了 15.7%(15.6 kg)。此外,10 mg、15 mg 组分别有 81.6% 和 86.4% 的患者减重 5% 以上,而安慰剂组比例为 30.5%,达到了共同主要终点。此外,还达到了所有关键次要终点,包括降低 A1C 和其他心脏代谢参数。
正是基于这项临床结果和针对非糖尿病肥胖症/超重患者的 SURMOUNT-1 临床结果,数据公布之际,礼来就已经在欧美迅速启动肥胖症上市申报流程。
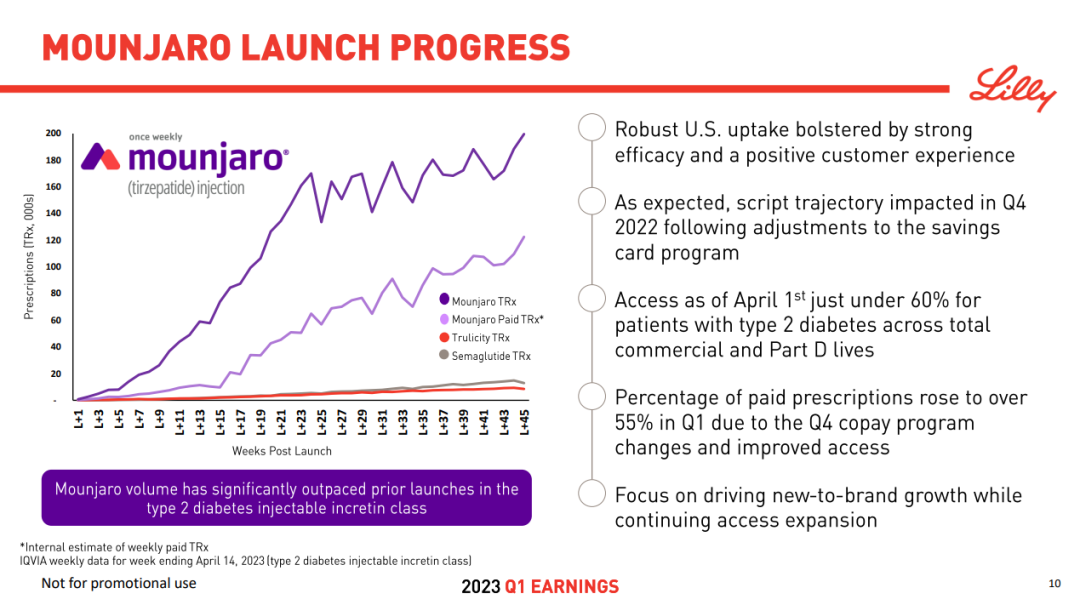
替尔泊肽自 2022 年 Q2 上市,到 2023 年 Q1 上市未满一年,已经斩获 5.685 亿美元的单季度销售额。据礼来此前提供的替尔泊肽相较于已上市两大 GLP-1 类药物度拉糖肽和司美格鲁肽的处方增长趋势,可以看出其放量速度是远超的。
仅仅 2 型糖尿病单独适应症就有如此威力,在肥胖症、OSA、NASH 等代谢领域适应症连番登场之后,替尔泊肽的未来潜力显然是不可限量的。单独肥胖症来看,今年年中,SURMOUNT-3 和 SURMOUNT-4 预计也将读出数据,前者结合生活方式控制治疗非糖尿病患者肥胖症,后者为维持治疗。
但礼来显然不仅满足于此。在这次会议中,其 GLP-1R/GIPR/GCGR 三靶点激动剂 Retatrutide (LY3437943) 也将披露 II 期临床结果,针对肥胖症、NAFLD 和 2 型糖尿病。这项结果将在北京时间 6 月 27 日凌晨 4 点 30 发布,此前据 Insight 数据库显示,Retatrutide 仅公布过安全性数据,本次预计将首次解开神秘面纱。
再回归到小分子,对于需要长期管理的慢病治疗,口服药物无疑具有难以匹敌的依从性优势,在这一方面诺和诺德早有口服司美格鲁肽(Rybelsus)珠玉在前。
不过礼来也不遑多让,Insight 此前在《礼来管线梳理:糖尿病、免疫、肿瘤、神经科学四大领域布局》文中提过,礼来对 GLP-1 的布局堪称是面面俱到,口服小分子自然也在其列。礼来的小分子 GLP-1 药物 Orforglipron 是当前全球唯一进入 III 期临床的同类药物,和曾经的替尔泊肽一样,属于赛道领头者。
在 ADA 年会上,Orforglipron 首次发布了 II 期临床数据,包括针对 2 型糖尿病的临床结果和针对肥胖症的临床结果,这两项结果也同时发布在柳叶刀和 NEJM 上。
肥胖症方面,经过 36 周 Orforglipron 治疗,45mg 剂量组减重 14.7%,相较安慰剂组减重 12.4%。糖尿病临床中同样有减重结果披露,Orforglipron 治疗 26 周时实现 10.1kg 减重,而安慰剂和度拉糖肽组则分别为 2.2kg 和 3.9kg。
Orforglipron 减重数据
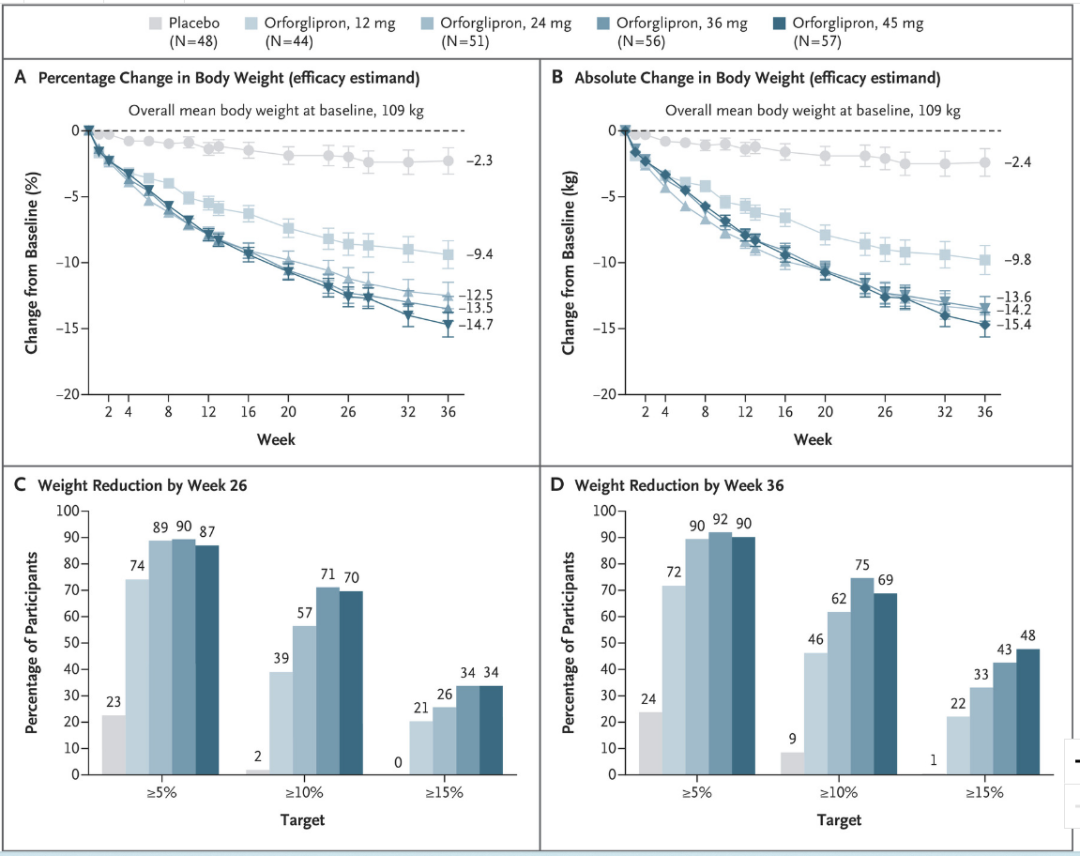
截图来自:Lancet
诺和诺德的口服司美格鲁肽则在高剂量版本上发力,在安全性不减的情况下进一步提升疗效。探索 50mg 口服司美格鲁肽治疗肥胖或超重的 III 期 OASIS 1 研究在 5 月 22 日宣告成功并发布数据,6 月发表于 Lancet,诺和诺德计划将在年内提交上市申请。OASIS 1 是一项为期 68 周的疗效和安全性试验,在 667 名患有肥胖或超重并伴有一种或多种合并症的成年人中比较每日一次口服司美格鲁肽 50 mg 或安慰剂的体重管理效果,两个治疗组都与生活方式干预相结合。
结果显示,口服司美格鲁肽在第 68 周时具有统计学意义和更好的体重减轻,达到了其主要终点。平均基线体重为 105.4 公斤,治疗组在 68 周实现了 17.4% 的减重效果,而安慰剂组则为 1.8%;此外,89.2% 的口服司美格鲁肽组患者在 68 周时体重减轻 ≥ 5%,而安慰剂组仅 24.5%。
除此之外,OASIS 2 - 4 还在进行中,将为口服司美格鲁肽带来更充分的临床证据。
不过,礼来和 GLP-1 小分子赛道的另一重磅参与者辉瑞认为,相较于口服司美格鲁肽,两家公司的 GLP-1 小分子依从性优势提升,因为口服司美格鲁肽在用药时需要空腹且配合饮用不超过 4 盎司的水,而小分子药物则不需要。
相较于双靶药物如替尔泊肽,单靶点口服小分子可能难以达到同样强大的治疗效果,或者与之相媲美。但有分析师认为,更低成本、更加方便的口服药物在中国等新兴国家可能优势会更加凸显,这或许也是国内药企踊跃入局的因素之一。
总结来看,诺和诺德和礼来两家 GLP-1 巨头在代谢领域角逐中分别走出了自己的特色:诺和诺德围绕关键产品司美格鲁肽,不走双靶路线,以 Cagrilintide 联用为突破口,疗效不输替尔泊肽,口服药方面则重推口服司美格鲁肽,高剂量版本在安全性不减的前提下疗效进一步提升;礼来将双靶、三靶的研究进行到底,推动 GLP-1R 激动剂与 GIPR、GCGR 激动作用的协同,口服 GLP-1 小分子当前走在全球最前列。
信达、恒瑞、先为达…国内企业涌现
国内药企的数据披露,是本次 ADA 年会中的另一大关键亮点。尤其恒瑞的 2 款新药,临床数据均为首次披露。
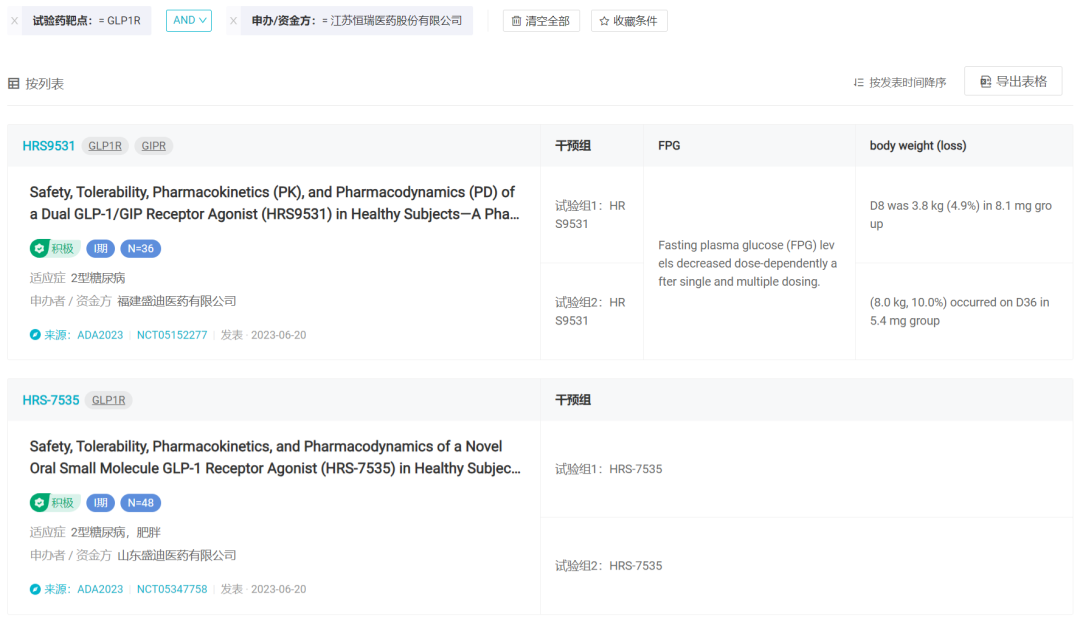
Insight 数据库显示,恒瑞开发有 2 款双靶点激动剂:针对 GLP-1R/GIPR 的 HRS9531(临床 II 期)和针对 GLP-1R/GCGR 的 SHR-1816(临床 I 期)。同时子公司山东盛迪还有一款 GLP-1R 小分子化药 HRS-7535 在研。
而在这次会议上,HRS9531 和 HRS-7535 数据均为首次披露。
恒瑞在本次会议上公布的 GLP-1 临床数据
截图来自:Insight 数据库网页版(http://db.dxy.cn/v5/)
NCT05152277(摘要编号 765-P)是 GLP-1R/GIPR 双靶点激动剂 HRS9531 在健康受试者中的 1 期单次(SAD)和多次剂量递增研究(MAD)。在 SAD 中,健康受试者随机(4:1)接受皮下注射 HRS9531(0.1、0.3、0.9、2.7、5.4 和 8.1 mg)或安慰剂。在 MAD 中,健康受试者被随机 (4:1) 接受 HRS9531(0.9、2.7 和 5.4 mg [2.7/2.7/4.0/5.4 mg 滴定])或安慰剂,每周一次,持续 4 周。试验主要终点是安全性和耐受性。
减重方面,在 SAD 中,体重减轻呈剂量依赖性,8.1 mg 组第 8 天的最大平均体重减轻为 3.8 kg (4.9%);在 MAD 中,0.9 - 5.4 mg 组在第 29 天平均减重 4.3 - 7.7 kg (6.7%-9.3%),最大减重 8.0 kg(10.0%),发生在 5.4 mg 剂量组第 36 天。
对于小分子 GLP-1R 激动剂 HRS-7535,1 期临床试验(NCT05347758,摘要编号 95-LB)纳入 SAD 和 MAD 各 24 例,MAD 治疗 29 天体重下降 4.38 kg。
信达则早在 2019 年 8 月就与礼来达成合作引进了 GLP-1R/GCGR 双重激动剂玛仕度肽(IBI362),这使该企业成为了国内药企在新一代 GLP-1 多靶点激动剂赛道中当之无愧的领头者。当前,信达已经在国内双线布局玛仕度肽的 2 型糖尿病和肥胖症适应症,且均推进到 III 期临床。
玛仕度肽权益流转图

来自:Insight 数据库网页版
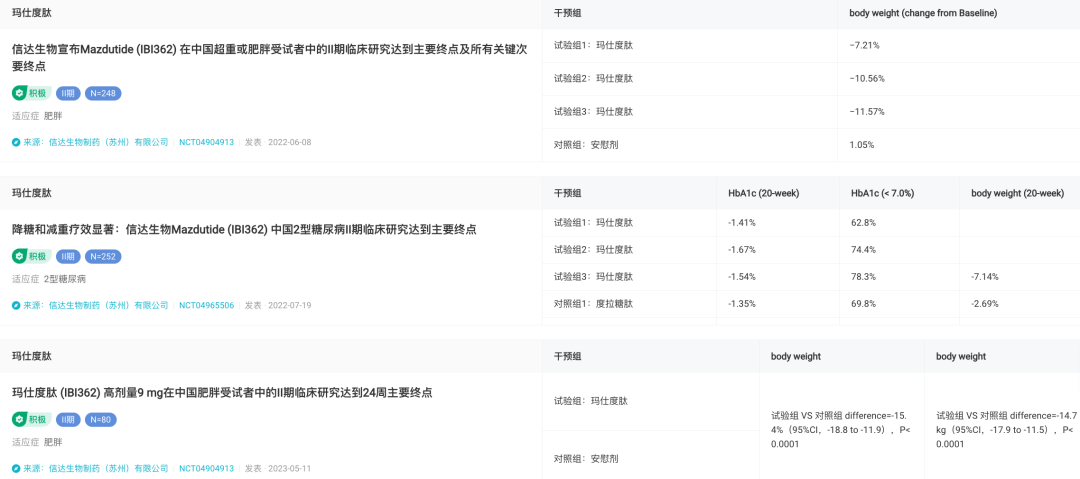
虽然本次 ADA 中信达未有新数据披露,但此前公布的 II 期临床结果显示,在中国超重或肥胖受试者中,6.0mg 玛仕度肽持续给药 24 周后患者体重下降 11.57%;且与安慰剂相比,可带来 12.6% 的体重降幅。此外,在需手术治疗的肥胖症患中,使用玛仕度肽 9mg 组 24 周后,平均减重达到 15.4%,体重减少 14.7kg。
玛仕度肽 II 期临床试验结果
信达启动的两项 III 期 2 型糖尿病临床试验代号分别为 DREAMS-1 和 DREAMS-2,后者是一项头对头度拉糖肽的临床试验;肥胖症 III 期临床试验代号则为 GLORY-1。从名字上,「梦想」与「荣耀」已经是野心昭昭。
目前相应试验入组进行顺利,信达预计在 2023 年末至 2024 年初就将提交玛仕度肽上市申请。不远的未来,玛仕度肽在中国的上市将为信达提供 PD-1 信迪利单抗之后第二个业绩腾飞点,支撑信达完成未来 4-5 年实现 200 亿量级营收的目标。
IBI362 已启动的 III 期临床试验
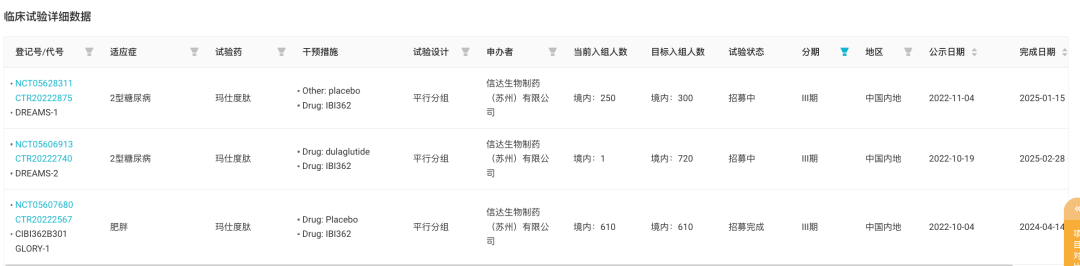
来自:Insight 数据库网页版
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..