近日,Intercept Pharmaceuticals宣布其奥贝胆酸(Ocaliva,OCA)治疗非酒精性脂肪性肝炎(NASH)的上市申请收到FDA的完整回应函(CRL)。
FDA在CRL中表示,他们已经完成了对该新药上市申请(NDA)的审查,并确定目前的数据不支持奥贝胆酸获得批准。根据CRL的内容,任何重新提交有关OCA治疗NASH的NDA,都至少需要成功完成REGENERATE研究的长期结果阶段。
基于FDA的此次CRL,Intercept决定停止NASH领域所有投资,重新聚焦到罕见病和感染性肝病领域。
01
屡战屡败的奥贝胆酸
奥贝胆酸是一种法尼酯X受体(FXR)激动剂,FXR通常在肠与肝脏中表达,是胆酸、炎症反应、纤维化与代谢通路的关键调节分子。由于FXR的活化可以降低肝细胞内的胆酸浓度,因此早在2016年5月,奥贝胆酸被FDA批准联合熊脱氧胆酸(UDCA)用于UDCA单药治疗应答不佳的原发性胆汁性胆管炎(PBC)成人患者,或单药用于无法耐受的PBC成人患者。
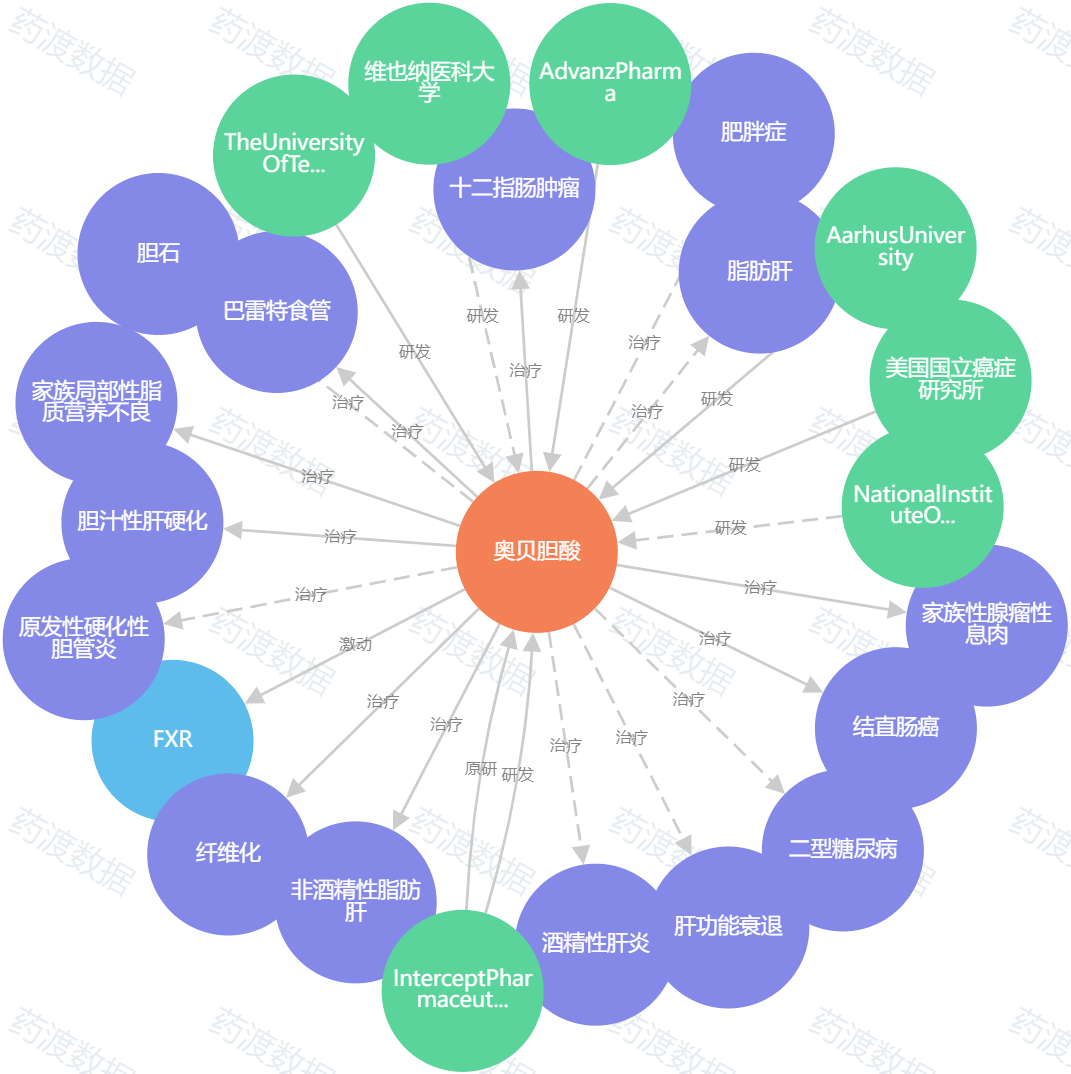
图1. 奥贝胆酸知识图谱,来源:药渡数据
在NASH适应症领域,奥贝胆酸是全球第一个进入III期临床的NASH药物。然而,其上市历程却一波三折。2020年6月,Intercept宣布收到FDA给出的奥贝胆酸治疗NASH引起的肝脏纤维化新药申请的CRL,暂时拒绝了奥贝胆酸该适应症的上市申请。CRL指出,奥贝胆酸基于替代组织病理学终点的潜在益处仍不确定,没有充分证据能够支持奥贝胆酸被批准用于NASH引起的肝脏纤维化适应症。FDA建议Intercept针对奥贝胆酸进行长期研究,以证明其安全性和有效性。
奥贝胆酸的此次申请是基于III期REGENERATE研究的两次期中分析数据。这是一项多中心、随机、双盲、安慰剂对照III期研究,共纳入2480例患者,旨在评估奥贝胆酸治疗伴有肝纤维化的非肝硬化NASH患者的安全性和有效性。
去年7月,Intercept公布了REGENERATE研究的第二次期中分析数据。结果显示,接受奥贝胆酸(25mg,每日1次)治疗18个月时有22.4%的患者实现了纤维化程度至少改善1级且未出现NASH恶化,而安慰剂组达到该指标的患者只有9.6%(p<0.0001);10mg奥贝胆酸组的数据与安慰剂组没有统计学差异。
不过,肝脏组织学的改善只能支持奥贝胆酸申请加速批准。今年5月19日,FDA就奥贝胆酸召开了胃肠药物咨询委员会。专家就奥贝胆酸治疗NASH适应症进行了投票,结果为12人反对,2人支持,2人弃权。专家委员会认为,奥贝胆酸的临床试验使用了替代终点,而且奥贝胆酸还有引起药物性肝损伤的风险。因此,此次FDA在CRL中提出需要完成长期随访的成功临床数据。
Intercept的失败再次验证了NASH赛道的残酷性,那么,NASH药物研发为何如此艰难?
02
复杂致病机理
导致药物研发困难
作为全球流行的主要肝脏疾病之一——非酒精性脂肪性肝病(NAFLD)是一种与胰岛素抵抗和遗传易感密切相关的代谢应激性肝脏损伤。NASH是NAFLD的一种严重形式,大约有15%-25%的NAFLD患者会发展为NASH。
NASH被定义为5%以上的肝脏脂肪变性,合并炎症、肝细胞损伤,伴或不伴肝纤维化。由于NASH阶段慢性炎症和肝纤维化将造成患者肝脏不可逆受损,被认为是进展成肝硬化、肝衰竭或肝细胞癌等终末期肝病的关键阶段。
有别于其他疾病,NASH的致病机理相当复杂。它的发生与脂肪酸累积、胰岛素抵抗、免疫信号异常等多个因素都有关系,而最重要的致病途径尚无定论。目前,在NASH领域最广泛接受的发病机制是二次打击假说。即酒精、肥胖、糖尿病等因素给肝脏带来了初次打击,诱发肝脏脂肪聚集,它增加了肝脏对第二次打击的敏感性。在此基础上,多种细胞或炎症因子导致脂肪酸过氧化,使肝细胞遭受第二次打击,造成炎症、坏死和纤维化。
由于发病机制复杂,目前除印度曾批准一款NASH药物外,无论是FDA、EMA还是NMPA,都不曾批准过一款针对NASH适应症的药物上市。
此前,由于研发的NASH新药存在无效或副作用大等问题,导致吉利德、诺华、辉瑞、Genfit等纷纷落败。例如Genfit公司研发的双PPAR α/δ激动剂——elafibranor,由于在治疗NASH和纤维化的III期RESOLVE-IT临床试验中,没有达到NASH消除且纤维化没有恶化的预定主要替代疗效终点,最终被迫终止该项目的研发。吉利德的ASK1抑制剂selonsertib也在两项临床试验失败后宣布终止。
尽管NASH药物研发困难重重,但药企们并未就此放弃。如今,这一领域已初现曙光。
03
后起之秀——Resmetirom
2022年12月,Madrigal宣布从罗氏引进的甲状腺激素受体β亚型(THR-β)激动剂Resmetirom用于治疗NASH的III期MAESTRO研究达到了双重主要终点。
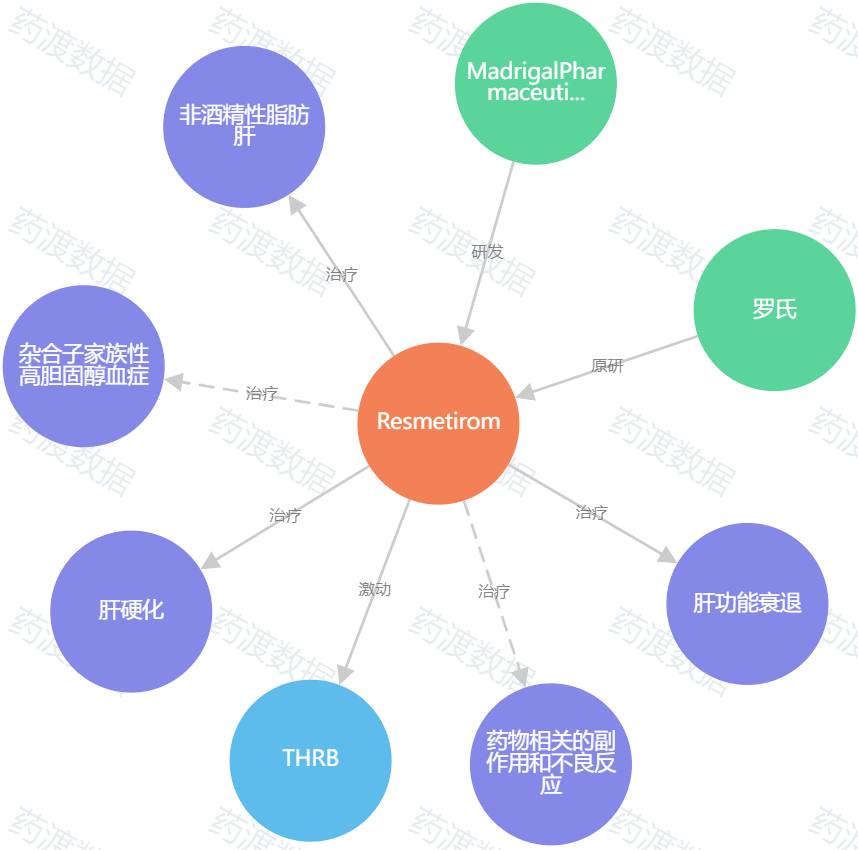
图2. Resmetirom知识图谱,来源:药渡数据
THR-β在人体肝脏中高表达,其能够调节脂代谢,降低低密度脂蛋白胆固醇(LDL-C)、甘油三酯和致动脉粥样硬化性脂蛋白,还可以通过促进脂肪酸的分解和刺激线粒体的生物发生来减少脂肪毒性并改善肝功能,进而减少肝脏脂肪。因此,THR-β激动剂具有通过调控多种肝脏代谢通路来治疗NASH的潜力。
在III期MAESTRO研究中,共纳入966例NASH患者,按1:1:1随机分为三组,分别接受Resmetirom 80mg、100mg或安慰剂治疗。结果显示:
在NASH缓解且纤维化不恶化的主要终点上,高剂量组、低剂量组和安慰剂组的发生率分别为30%、26%、10%;
在纤维化改善≥1级且NASH不恶化的主要终点上,三个组的发生率分别为26%、24%、14%;
在次要终点LDL-C降幅上,三个组分别为-16%、-12%、1%。
结果意味着Resmetirom不仅能够缓解NASH,还带来了心血管指标的改善。
在安全性方面,Resmetirom的表现也是非常不错,最常见的不良反应是治疗初期出现的轻中度腹泻和恶心。综合来看,Resmetirom已大大超出预期。因此,在Madrigal公布这一临床数据的当天,公司股价暴涨234.68%。受这一事件的催化,国内“NASH概念股”公司股价也大幅上涨。那么,国内有哪些公司在布局NASH药物研发的管线?
04
国内NASH药物研发进展
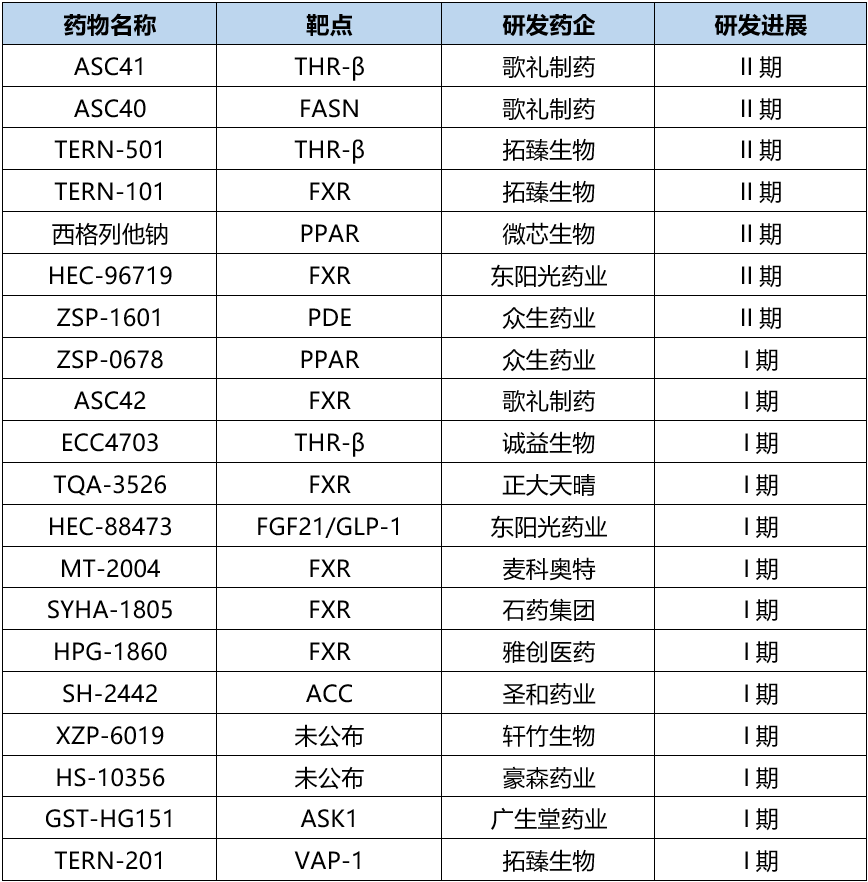
表1. 国内部分在研NASH药物,来源:根据公开资料整理
歌礼制药
在国内,歌礼制药在抗病毒和抗肝病药物研发领域建树颇深。围绕NASH领域,歌礼制药进行了多项前瞻性布局。其中ASC41是由歌礼自主研发的一款靶向肝脏的前药,其活性代谢产物为THR-β激动剂。与Resmetirom相比,ASC41与THR-β受体结合亲和力以及处理能力更强。
ASC40是歌礼/Sagimet Biosciences合作研发的一款靶向脂肪酸合成酶(FASN)的抑制剂。FASN是新脂质合成途径中的一种关键酶,能催化合成棕榈酸,以使其他脂肪酸和复合脂质得到进一步分解。该通路导致NASH患者肝脏中产生多余的脂肪,并激活纤维化和炎症机制。
在ASC40治疗NASH的IIb期临床试验中,结果显示,NASH各项关键标志物有统计学意义上的显著减少,包括肝脏脂肪含量、炎症和纤维化标志物,进一步验证了早期研究中观察到的结果。
拓臻生物
拓臻生物开发的THR-β靶点管线TERN-501,于今年3月在美国启动了单药以及与其旗下内源性胆汁酸调节因子(FXR)激动剂TERN-101联合用药的II期临床研究。在NASH的新药研发上,拓臻生物还布局了VAP-1抑制剂TERN-201等。
众生药业
众生药业的ZSP-1601是一款泛磷酸二酯酶(PDE)抑制剂,具有全新的作用机制。临床前研究结果表明,ZSP-1601在多个肝纤维化动物模型上展现了显著抗炎和抗肝纤维化的作用。另外,众生药业的NASH新药ZSP-0678也已进入了I期临床阶段,该药物为过氧化物酶体增殖物激活受体(PPAR)α/δ双重激动剂。
此外,国内还有雅创医药的HPG-1860、圣和药业的SH-2442、豪森药业的HS-10356等均进入临床试验阶段。
05
市场潜力巨大 临床需求未满足
何时迎来爆发?
根据流行病学调查数据预估,全球NASH患者约为1.9亿~5.8亿人,庞大的患者群体也意味着巨大的NASH药物市场。据Evaluate Pharma和弗若斯特沙利文预测,2025年全球NASH药物市场规模可达350亿~400亿美元。
然而,面对将近400亿美元的蓝海市场,无论是FDA、EMA还是NMPA,都不曾批准过一款针对NASH适应症的药物上市,这意味着NASH有大量的临床治疗需求尚未被满足。因此,尽管NASH药物研发充满着巨大的不确定性,仍然有越来越多的药企躬身加入其中。未来如果Resmentirom能率先打破僵局,将刺激NASH领域的大爆发。同时,希望国内创新药企能够快速跟上,在NASH领域实现弯道超车。
参考资料:
1. Intercept receives complete response letter from FDA for obeticholic acid as a treatment for pre-cirrhotic fibrosis due to NASH.
2. Zou, Huimin et al. (2022) Epidemiology and disease burden of non-alcoholic steatohepatitis in greater China: a systematic review. Hepatology international 16,1: 27-37. DOI:10.1007/s12072-021-10286-4.
3. 《医药行业:NASH药物,百亿市场下一城》,2023-01-06,西南证券.
4. Akero hits endpoints in midphase NASH trial, linking candidate to improvements in fibrosis. Retrieved September 13, 2022 from https://www.fiercebiotech.com/biotech/akero-hits-endpoints-midphase-nash-trial-linking-candidate-improvements-fibrosis.
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..