今年5月,世界上首位接受CAR-T治疗的白血病儿童患者艾米莉将要迎来自己无癌生存的第十一年纪念日。
在过去的数年间,CAR-T的出现极大地改变了癌症免疫治疗领域的格局,它不仅让艾米莉这样曾经在临床上被宣判“死刑”的患者重获新生,也让免疫疗法的理念成为了现实——通过利用免疫系统的力量来对抗恶性肿瘤。
近日,知名学术期刊《自然》杂志的子刊Nature Reviews Clinical Oncology发表了一篇综述,系统整理总结了CAR-T治疗患者的长期随访疗效和毒性数据。在今日的内容中,药明康德内容团队将和读者们共同分享这篇文章。

CAR-T疗法的长期治疗结局追踪
(1)CD19靶向型CAR-T治疗B细胞淋巴瘤和慢性淋巴细胞性白血病
研究人员分析了临床试验中CD19靶向型CAR-T治疗的长期疗效数据,这些临床研究主要在复发/难治性(R/R)B细胞恶性肿瘤和慢性淋巴细胞性白血病(CLL)患者中进行。患者在CAR-T治疗后≥2年病情仍持续缓解,并且后续无需任何巩固性治疗。这些长期、持久的缓解效果存在于所有目前获批的CD19靶向型CAR-T产品,且适用于所有血液恶性肿瘤——包括侵袭性B细胞淋巴瘤、滤泡性淋巴瘤、外周T细胞淋巴瘤、以及CLL。
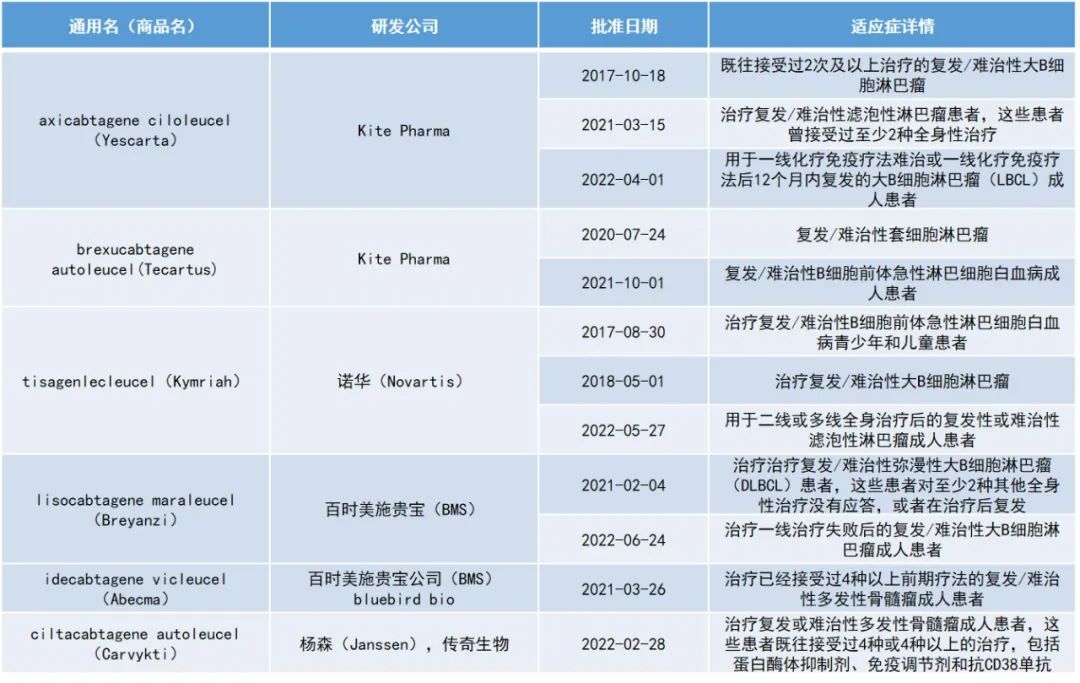
▲目前获批的六款CAR-T产品(数据来源:Nature Reviews Clinical Oncology,药明康德内容团队制图)
在最新的随访中,部分患者接受axicabtagene ciloleucel治疗后完全缓解(CR)持续时间超过43个月,最长可达113个月。接受tisagenlecleucel治疗的患者超半数在5年后仍然保持缓解。总体而言,这些结果表明,接受CD19靶向型CAR-T治疗的某些复发和/难治性B细胞淋巴瘤患者有望在不需要进一步干预的情况下实现完全治愈。
(2)CD19靶向型CAR-T治疗B细胞急性淋巴细胞白血病
B细胞急性淋巴细胞白血病(B-ALL)患者在接受CAR-T治疗后的初始CR率非常高(62%到86%),其中大部分为微小残留病(MRD)阴性缓解。中位无事件生存期(EFS)在各研究之间有所不同,这可能是因为大多数研究所纳入患者的异质性较大造成的。此外,一些患者在缓解期间接受了巩固性异基因造血干细胞移植(HSCT)治疗,这些患者的治愈是否因CAR-T细胞治疗引起变得难以判断。
Tisagenlecleucel和brexucabtagene autoleucel的疗效相似,但与其他B细胞恶性肿瘤患者相比,大多数B-ALL成年患者的缓解时间较短。在当前获批的几种CAR-T疗法中,目前只有tisagenecleucel被批准用于25岁以下的B-ALL患者。接受CD19靶向型CAR-T细胞疗法的年轻(儿童和年轻成人)患者与成年人群相比,生存结果更具优势。
目前,关于B-ALL患者在CAR-T细胞治疗后是否需要采用巩固性异基因HSCT以获得持久缓解仍有争议。与其他CD19靶向型CAR-T相比,未接受HSCT的儿童患者使用tisagenecleucel的长期缓解率更高。但在成年患者中,巩固性异基因HSCT通常被推荐用于那些在接受CD19靶向型CAR-T细胞治疗后达到CR的患者。
总的来说,来自B-ALL患者的研究数据表明,CD19靶向型CAR-T治疗后的CR率非常高,在许多研究中甚至超过80%。但在接受tisagenecleucel治疗的儿童患者中,实现长期EFS的比例不到一半。与那些患有B细胞淋巴瘤的人相比,B-ALL患者更有可能实现CR,但较低比例的CR患者可以在没有后续治疗的情况下被治愈。
(3)BCMA靶向型CAR-T治疗复发/难治性多发性骨髓瘤
相较于CD19靶向型CAR-T,BCMA靶向型CAR-T治疗复发/难治性多发性骨髓瘤(RRMM)的研究相对较少,RRMM患者所报告的总缓解率(ORR)为73-100%,CR或严格CR为33%-83%,其中以MRD阴性缓解较为常见。部分患者无需巩固或维持治疗就能维持超过1年的无进展生存期(PFS)。
在一项针对具有仅重链抗原识别结构域的人源BCMA靶向型CAR的试验中,RRMM患者的中位PFS持续时间为18个月,并且没有进行任何维持治疗。这种CAR-T单一治疗与基于单克隆抗体的方法形成鲜明对比,后者需要持续治疗。
针对所有已上市CAR-T产品的长期随访研究(>1年)结果显示,RRMM患者在BCMA靶向型CAR-T治疗后可以在无维持治疗的条件下获得长期缓解,尽管随着时间的推移疾病进展的风险持续存在。
与长期缓解相关的因素
根据现有的资料,研究人员将影响CAR-T治疗持久缓解的相关因素归纳为六点:肿瘤缓解程度(depth of response),肿瘤类型,肿瘤负荷及位置,淋巴细胞清除性化疗,以及体内CAR-T的水平。
(1)肿瘤缓解程度
多项研究表明,初始缓解程度较深的患者更有可能出现长期缓解,这一发现在多种血液肿瘤,包括B细胞淋巴瘤、CLL、B-ALL和MM的研究中得到了证实。
患有B细胞淋巴瘤的患者,如果最佳缓解程度仅为部分缓解,那么他们不太可能在之后实现长期的治愈性缓解。相反,那些获得CR的患者可以实现治愈性缓解。需要注意的是,MM和B-ALL患者通常可以获得MRD阴性缓解,但后来仍会出现疾病复发。由此看来,在CAR-T治疗后实现长期缓解,深度初始反应似乎是必要的,但却不足以保证长期缓解。
(2)肿瘤类型
恶性肿瘤的类型和特征在一定程度上也预测了病情缓解的持久性。与B-ALL或MM相比,B细胞淋巴瘤患者实现CR的可能性较小;然而,B细胞淋巴瘤患者获得持久缓解的可能性高于其他病种。
(3)肿瘤负荷
基线时肿瘤负荷是预测恶性肿瘤对CAR-T治疗反应的另一个因素。与所有恶性肿瘤(包括B细胞淋巴瘤、B-ALL和MM)中肿瘤负荷较低的患者相比,治疗开始时肿瘤负荷较高的患者不太可能获得并保持深度缓解。此外,其他共性的因素还包括淋巴结外B细胞淋巴瘤和髓外病变(包括髓外B-ALL和髓外MM),这些因素的存在预示着较差的预后。
(4)淋巴细胞清除性化疗
接受淋巴细胞清除性化疗是一个与病情缓解相关的确证因素。研究数据显示,在进行CAR-T治疗前接受淋巴清除性化疗的B细胞淋巴瘤和B-ALL患者表现出更好的缓解效果。对于MM患者来说,在CAR-T治疗前清除淋巴细胞可以创造一个有利的免疫环境,使得移植到体内的CAR-T细胞具有最佳的增殖能力和功能,这一机制已得到了动物模型研究和人类临床试验的数据支持。
(5)CAR-T细胞水平
治疗后CAR-T细胞水平是预测反应持久性的重要因素。CAR-T细胞在注入体内后迅速扩增达到峰值水平,然后以相对低的水平持续数年。较高的血CAR-T细胞峰值水平通常与初始缓解和持久缓解有关。
然而,在B细胞淋巴瘤患者中,研究者们观察到无需CAR-T细胞的长期持续存在也可以实现持久缓解。同样地,在一些MM患者中,即使没有可检测的长期CAR-T细胞,患者依然获得了病情持久缓解。当然,这个结论不能一概而论,CAR-T细胞水平的持久性对B-ALL患者的持久缓解十分重要。
尽管如此,从现有数据来看,持久缓解所需的CAR-T细胞维持时间和程度尚不清楚,并且可能因不同的CAR结构和肿瘤类型而异
正在进行中的研究
目前的研究旨在优化CAR-T细胞治疗过程,以期改善CR率和长期PFS的关键指标。
癌症复发是CAR-T治疗过程中面临的首要挑战,其中的主要复发机制便是抗原逃逸——当癌细胞不再表达目标抗原时,CAR-T治疗不再有效,从而导致癌症卷土重来,它也是影响CAR-T疗效持久性的最重要因素之一。为解决这一问题,科学家们正在开发双重抗原的CAR-T,除了CD19之外,研究最为广泛的是CD20和CD22——它们都在恶性B细胞中高表达。现阶段这类双重靶向CAR-T已进入临床试验阶段,临床数据表明,靶向一种以上的抗原并不能百分百规避抗原逃逸的问题,这种策略可能需要与CAR-T的其他方面改进相结合。
另一热点研究方向是改善CAR-T的抗原结合域可以增强其功能。大多数批准的CAR-T细胞产品使用小鼠衍生的成分,由于抗CAR免疫反应,输注后可能会限制CAR-T细胞水平。现在,多个研究小组已经开发出全人源化的CAR-T,并在临床试验中进行了测试。抗原结合结构域的另一个潜在改进是用仅重链的可变域取代单链可变片段。仅重链的结构域具有尺寸更小、更易于遗传操作、低免疫原性的优点。在临床试验中,与接受含有单链可变片段的CAR-T的患者相比,接受包含仅重链可变域CAR-T治疗的患者显示出更高的ORR和更长的缓解持续时间。
此外,目前的CAR-T治疗可能需要数周时间才能实施,这对于那些对一线化学免疫疗法有抗性的恶性肿瘤患者不太可行,这一问题也是制约细胞疗法发展的瓶颈之一。正如细胞治疗行业的资深专家、Notch Therapeutics的总裁兼首席执行官David Main先生在接受药明康德迅猛新分子访谈时指出,“我们从患者身上获取免疫细胞并进行一些改造,然后把这些细胞输回患者体内来攻击癌细胞。这种方法只能用于很少的患者,不是所有的患者都能健康地提供自己的免疫细胞。而且细胞疗法的生产过程很长,当我们准备给患者输回他们的细胞时,患者的疾病可能已经发生了进展。此外,生产过程中的波动,也会让细胞的表现不如预期。”因此,如果能从任意来源的多能干细胞中获得均一的T细胞,制备成“现货型”CAR-T产品,供患者取用将有效解决这类问题。
此外,还有学者提出,如果在治疗恶性肿瘤的过程中更早地输入CAR-T细胞可能会避免这些问题并提高缓解率。在临床试验中,仅在两个周期的一线化学免疫治疗后,高危侵袭性B细胞淋巴瘤患者便接受CAR-T作为二线治疗,随后获得了高达78%的CR率。其中,86%的CR患者获得了持久的缓解,其中位随访时间为16个月。采用这种“早治”策略的患者,其体内的循环CAR-T细胞数量也高于“晚治”患者。现阶段,还有更多针对CAR-T“早治”策略的研究仍在进行中。
CAR-T的实施流程是另一个需要优化的领域,具体包括采血前、桥接治疗阶段、以及淋巴细胞清除性化疗。目前的实践基于以前的试验方案和专家指导,关于这些药物如何影响CAR-T反应的数据有限,迫切需要进行更多研究来帮助我们了解特定药物在CAR-T治疗的所有步骤中的确切作用。
最后,需要优化的还有CAR-T细胞制造方案。T细胞可能呈现一系列具有异质性功能的分化状态,而输注的CAR-T细胞特征与随后的治疗反应之间存在联系,找到理想的T细胞组成是科学家们的又一努力方向。研究结果显示,分化程度较低的幼稚T细胞或中央记忆T细胞对于有效的过继细胞治疗似乎很重要。此外,更长的体外培养时间会导致T细胞衰竭和不利的表型。因此需要进一步的研究以缩短CAR-T细胞制造时间、产出性能更优的细胞。
结语
经过近10年的发展,CAR-T已经成为了众多血液恶性肿瘤的有效治疗选择。总体来看,其长期治疗数据强劲、总体毒性水平低,有望作为单一治疗或配合同种异体HSCT用于治疗B细胞淋巴瘤、B-ALL、MM在内的多种恶性肿瘤,并帮助这些患者实现长期的治愈性缓解。本综述还讨论了正在进行中的、旨在改善CAR-T疗效的研究策略,相信在不久的将来这些研究成果将被转化为临床应用,进一步提高CAR-T治疗的持久性。
参考资料:
[1] Cappell, K.M., Kochenderfer, J.N. Long-term outcomes following CAR T cell therapy: what we know so far. Nat Rev Clin Oncol (2023). https://doi.org/10.1038/s41571-023-00754-1
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..