大家生活中偶尔会发现:即使是生长在同一环境的同卵双胞胎,性格、健康等方面也会存在较大差异,这种现象或可用“表观遗传学”来解释。表观遗传学的概念最早在1942年由研究胚胎发育的英国生物学家沃丁顿(Conrad Waddington)正式提出[1]。
关于“表观遗传及其在细胞命运决定中的作用”一直是学术界争论的热点议题,此前饶毅教授等学术大牛也曾就该命题进行过公开辩论。即便如此,表观遗传异常是导致肿瘤发生的重要因素毋庸置疑。
其实,表观遗传学相关理论很早就被运用于药物开发过程。据不完全统计,截止目前全球上市的表观遗传学机制相关的药物有10余款,其中最广为人知的是DNMT抑制剂阿扎胞苷、地西他滨以及微芯生物研发的HDAC抑制剂西达本胺。
而EZH2虽然是表观遗传学的热门靶点之一,但直到2020年才有作用于该靶标的药物获批上市。近期,恒瑞医药的EZH2抑制剂SHR2554以近7亿美元总金额Lisence out给海外Biotech的消息,再次加深了公众对表观遗传学研究关注度。
过表达于前列腺癌组织
EZH2(enhancer of zeste homolog)全称为“调味增强子同源物2”,属于PcG蛋白(Polycomb group protein)中关键成员之一, 也是pRC2(Polycomb Repressive Complex 2,多梳抑制复合体2)的核心亚基之一,具有组蛋白甲基化转移酶活性, 在表观遗传修饰过程中扮演重要角色[2]。
前列腺癌是一种高发的男性肿瘤。虽然手术、放化疗被广泛应用于早期列腺癌治疗,但是转移性前列腺癌仍然基本无法治愈。早在21世纪初,科学家通过基因表达谱分析发现,PcG蛋白中的调味增强子同源物2(EZH2)在激素难治性转移性前列腺癌中过度表达。
而靶向EZH2的小干扰RNA(siRNA)双链分子可以减少前列腺细胞中EZH2蛋白的量,并在体外抑制细胞增殖。在前列腺细胞中人为表达EZH2可以抑制特定基因转录。科学家推测EZH2的失调表达可能参与前列腺癌的进展,并将其作为区分惰性前列腺癌和高级别前列腺癌的生物标记物(biomarker)[2]。
虽然EZH2最初是在前列腺癌组织中发现,但是随着基础研究的不断推进,科学家后来又发现也在其他多种肿瘤中高表达,并逐渐成为抗肿瘤药物开发的重要靶点。与正常组织相比,肿瘤组织中往往发生EZH2表达的上调,且其表达水平与肿瘤的恶性程度呈正相关。
尤其是2002年Cao R等人在《Nature Genetics》上发表了一篇题为“Role of histone H3 lysine 27 methylation in Polycomb-group silencing”的文章,描述了EZH2作为Polycomb蛋白复合物的一个组成部分,能够在细胞核中对组蛋白H3K27进行甲基化修饰,并通过调节靶基因的表达来影响干细胞分化和发育[3]。研究人员通过筛选化合物库和结构优化,也顺势开发了诸多针对EZH2单靶点或多靶点在研药物。
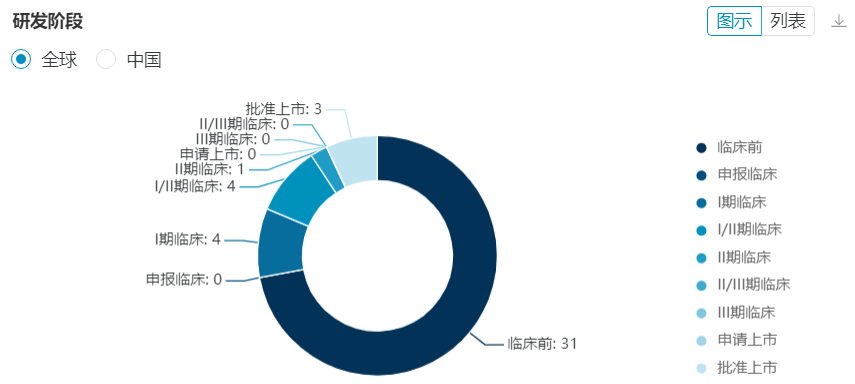
医药魔方NextPharma数据库显示,全球已经披露的EZH2项目接近50款,其中95%以上布局适应证为肿瘤。
EZH2抑制剂接连上市
如果算上强生的阿司咪唑(astemizole),截止到目前,全球共有3款EZH2抑制剂获批上市。阿司咪唑是FDA批准的H1组胺受体拮抗剂,据报道可以通过破坏EZH2-EED复合物来抑制PRC2驱动的淋巴瘤细胞的增殖[4]。
Ipsen从Epizyme公司收购的Tazverik(tazemetostat,他泽司他)是FDA批准的首个口服EZH2小分子抑制剂,分别于2020年1月和2020年6月获FDA加速批准用于治疗晚期上皮样肉瘤(ES)患者和某些复发/难治性滤泡性淋巴瘤(FL)的患者,也是治疗ES患者的首个疗法。根据Ipsen公司2022年财报,Tazverik年收入1300万欧元。
2021年8月,和黄医药斥资超3亿美元向Epizyme公司引进了他泽司他于大中华区的开发及商业化权利。2022年5月,他泽司他的临床急需进口药品申请获批,并率先于海南先行区使用,与FDA批准的适应症一致。另外,和黄医药还于2022年8月启动了用于三线以上治疗复发/难治性FL患者的中国II期桥接研究(NCT05467943),预计最快2024年或2025年提交上市申请。
第一三共研发的EZH1/2双重抑制剂Ezharmia(Valemetostat,伐美妥司他)于2022年9月26日获得日本厚生劳动省(MHLW)批准上市,也是全球第一个获得监管批准的EZH1/2双重抑制剂,用于治疗复发或难治性成人T细胞白血病/淋巴瘤 (ATL)。
国内在研EZH2项目
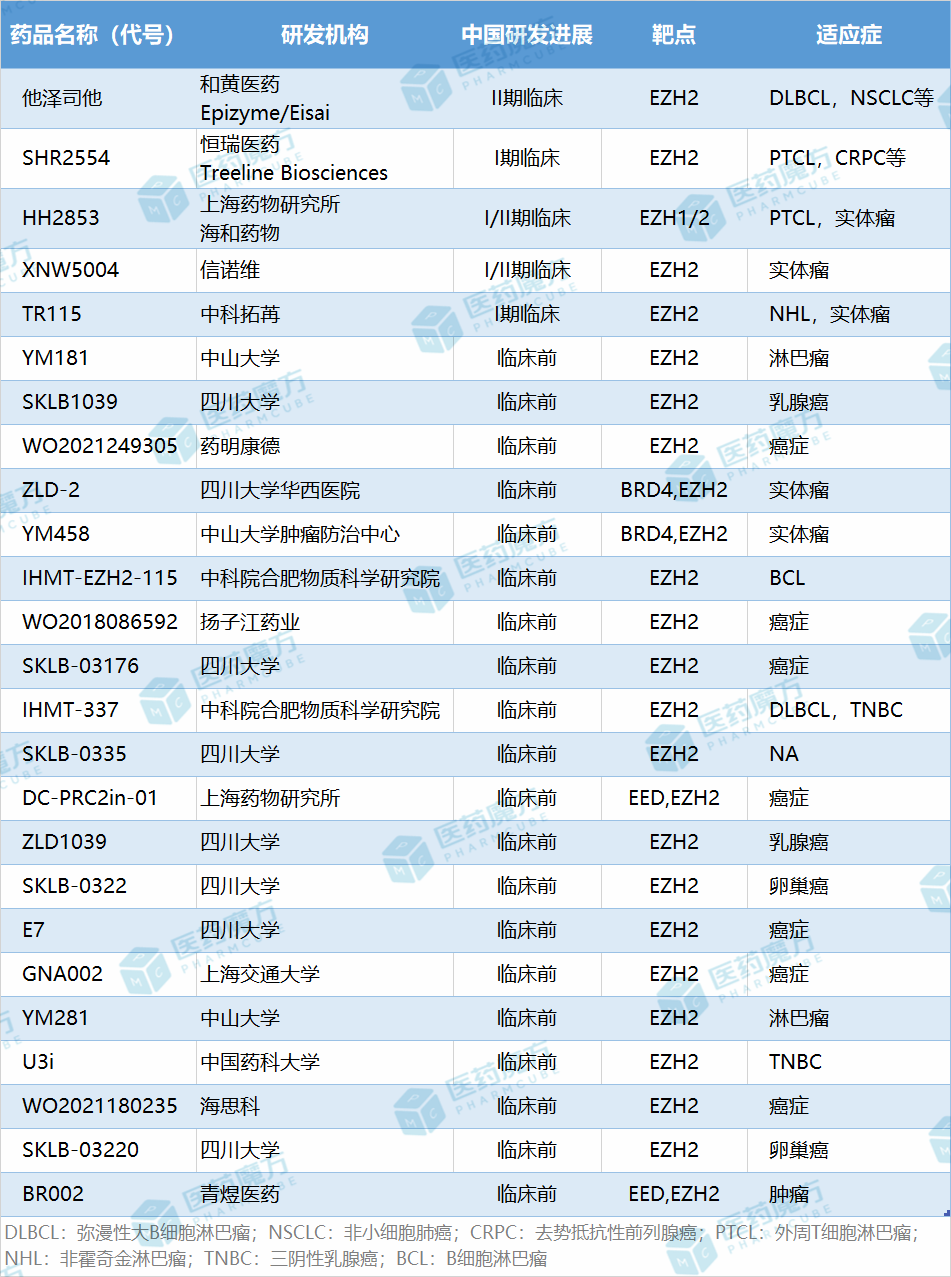
国内包括和黄医药、恒瑞医药、信诺维医药等公司皆有布局EZH2抑制剂项目。
SHR2554是恒瑞医药开发的新型、高效、选择性的口服EZH2抑制剂,可以选择性强效抑制野生型和突变型EZH2酶活性。2022年7月,SHR2554首个人体安全性、药代动力学、药效学和临床活性的I期临床研究成果正式全文在线发表于国际权威学术期刊《柳叶刀·血液学》[5]。2023年2月,恒瑞将SHR2554(EZH2)项目在除大中华区以外的全球范围内开发、生产和商业化独占权利有偿许可给Treeline公司,交易总额有望超7亿美元。
HH2853是一种新型、高效、特异性的EZH1/2双重抑制剂,系统的非临床研究表明,该药物具有优异的体内外抗肿瘤活性,在所有测试种属中均有良好的药代动力学性质和优异的安全性,显示出良好的临床应用开发前景。2020年,HH2853拟用于治疗复发性/难治性非霍奇金淋巴瘤和晚期实体瘤患者的临床试验先后在美国、中国开展,目前已进入II期临床阶段。
XNW5004片是信诺维公司自主研发的底物竞争型的、选择性、小分子EZH2抑制剂。信诺维公司于2021年4月首次获批临床,而后又获批了联合恩扎卢胺、奥拉帕利、特瑞普利单抗,开展治疗既往醋酸阿比特龙治疗失败的转移性去势抵抗性前列腺癌(mCRPC)、治疗标准治疗失败的晚期实体瘤、标准治疗失败的晚期实体瘤的研究。
信诺维在ASH2022会议披露,XNW5004在各个剂量组、各瘤种中均展现出良好抗肿瘤疗效,尤其在滤泡性淋巴瘤人群中的疗效已远优于同类选择性EZH2抑制剂Tazemetostat和PF-06821497。同时XNW5004具有良好的安全性和耐受性,递增阶段各剂量组无DLT事件发生,安全性和耐受性结果也优于Tazemetostat和PF-06821497。
结语
表观遗传学研究使公众意识到,肿瘤的发生和进展不止是由基因突变导致。染色体中组蛋白的修饰特征作为表观遗传的重要表现形式,其变化往往能够改变细胞的转录,而基因转录的开与关与否又决定着癌基因和抑癌基因的转录调控。
除EZH2之外,包括组蛋白去乙酰化酶(HDAC)、DNA甲基转移酶(DNMT)、组蛋白结合蛋白BET等表观遗传学中靶点在癌症治疗中显示出治疗潜力。历经80余年的表观遗传学研究,是否会为包括肿瘤在内的疾病治疗提供更多选择或治愈希望?我们也将持续关注。
- 参考资料 -
[1] Seminars in Cell & Developmental Biology. Volume 14,Issue 5, October 2003, Pages 301-310.
[2] Nature.2002 Oct 10;419(6907):624-9.
[3] Science.2002 Nov 1 ; 298(5595):1039-43.
[4] J Med Chemactions.2014 Nov 26;57(22):9512-21.
[5] Lancet Haematol 2022, 9, e493-e503.
认真落实巡视组反馈意见,进一步规范协
按照四川省市场监督管理局党组巡视..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于召开会长办公会的通知
各会长、副会长单位: 根据四川..四川省医药保化品质量管理协会组织召开
2025版《中国药典》将于2025年10月..四川省医药保化品质量管理协会召开第七
四川省医药保化品质量管理协会第七..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..学习传达中央八项规定精神专题会议
2025年4月22日,协会党支部组织召..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..