今天(2月28日)是第16个国际罕见病日。
罕见病是指患病率很低、很少见的疾病。世界卫生组织(WHO)将罕见病定义为患病人数占总人口0.65‰~1‰的疾病或病变。但罕见病种类多达6000~8000种,因此这类患者并不罕见,且面临巨大未满足的临床需求。根据2022年发表于《自然》子刊Nature Genetics的一篇文章,在全球范围内,有超过3亿人患有罕见病,然而90%以上的罕见病没有获批的治疗方法(孤儿药)可用。
令人欣喜的是,受生物医药产业、监管机构、患者组织等社会各方的积极推动,近年来罕见病领域的药物开发持续活跃。以2022年美国FDA批准的新药为例,44款新药中孤儿药就有25个;且过去3年,FDA批准的孤儿药数量在全年获批新药的占比均在50%以上。纵观更广泛的全球研发管线,700多种孤儿药正在开发中,涵盖细胞和基因治疗、RNAi等多种新分子类型,37%以上进入后期开发阶段。这些也意味着,未来几年许多罕见病患者将有望迎来新的治疗选择。
政策支持与科学进步,助力孤儿药加速开发
孤儿药研发热情在最近十年持续高涨。根据FDA历年发布的新药获批报告和公开资料,最近5年(2018年~2022年)共计有141款孤儿药在美国获批,相当于每年获批28款,相比上一个5年(2013年~2017年)增加了90%。这些孤儿药的到来,为很多此前缺乏治疗手段的罕见病患者带来了新希望。
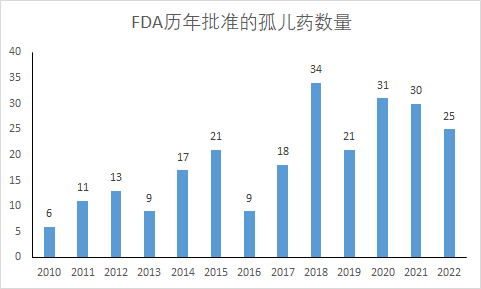
药明康德内容团队制图
研究发现,针对罕见病开发新药的成功率比其它疾病更高。根据BIO、Informa Pharma Intelligence和QLS于2021年联合发布的一项报告:在2011年~2020年,罕见病(不含肿瘤适应症)药物从1期临床到获得FDA批准上市的平均成功率为17.0%,高于整体药物的平均开发成功率7.9%。而其中的罕见肿瘤适应症药物从1期临床到获得FDA批准的平均成功率(6.8%)也高于非罕见肿瘤适应症(4.4%)。
过去30年来,研究人员已在开发治疗罕见疾病的药物方面取得了巨大进展,这也是监管政策变化与科学进步相结合的成果。
根据美国临床与经济评价研究所(ICER)于2022年4月份发布的一份报告,在1983年《孤儿药法案》(ODA)通过之前,FDA历史上只批准了38种药物用于治疗罕见病。而自ODA通过以来,FDA至今已批准了600多种具有罕见病适应症的药物。另一份来自FDA的统计报告显示,自1992年FDA加速批准政策实施以来,截至2022年12月31日,已有共计290种创新疗法通过加速批准。其中就包括许多孤儿药,如镰状细胞贫血症疗法voxelotor、杜氏肌营养不良症新药casimersen、治疗查加斯病的苄硝唑等。
在中国,罕见病目录、临床急需境外新药名单、优先审评等政策的实施,也促进了很多罕见病新药的加速到来。根据中国国家药监局药品审评中心(CDE)发布的药品审评报告,2019年CDE批准了16个用于治疗罕见病的临床急需药品,较2018年增长了60%;2020年CDE完成了13个用于治疗罕见病的临床急需药品的技术审评,这些药品均在3个月内完成审评。同时,罕见病用药也是中国医保关注的重点。根据央视网报道,在2022年医保药品目录谈判中,7款罕见病治疗用药谈判成功,目前新版医保目录包含52种罕见病用药,覆盖27种罕见病。
除了政策变化,创新技术和药物发现方法的出现,尤其是个性化医疗和基因疗法的快速发展,也加速了罕见病治疗药物的开发。根据ICER报告,促成更多孤儿药涌现的一个重要科学因素是2003年人类基因组计划的完成。这促使人们对罕见病的遗传和生物学基础有了新的认识,使科学家能够根据新的生物标志物更精确地针对患者群体进行治疗。据估计,70%以上罕见病是遗传性的,截至2020年,正在开发的所有细胞和基因疗法中有1/3针对罕见病。
针对300多种罕见病的数百种药物正在开发中
在各种利好因素下,不少生物医药公司纷纷将目光投向孤儿药开发。根据美国药品研究与制造企业协会(PhRMA)于2021年底发布的孤儿药报告,截至2021年11月30日,全球有791种孤儿药正在开发中,针对300多种罕见病。其中,共计288种针对血液肿瘤和其它罕见肿瘤,占比高达35%;192种用于遗传性疾病;56种用于神经系统疾病;54种用于血液疾病。这些在研产品中,已进入3期临床或者提交上市申请的后期产品占比大约在37%以上。
从药物类别来看,除了传统的单克隆抗体和小分子靶向药物,包括细胞和基因治疗、RNAi、抗体偶联药物(ADC)、双特异性抗体等在内多种新分子类型也在罕见病药物开发中备受看好。例如:反义寡核苷酸PRAX-222(治疗SCN2A功能获得性癫痫)、CRISPR/Cas9基因编辑疗法CTX001(治疗罕见血液疾病)、RNAi疗法belcesiran(治疗α-1抗胰蛋白酶缺乏症相关肝病)、四价双特异性细胞接合剂AFM13(治疗T细胞淋巴瘤)、ADC疗法BA3011(治疗软组织肉瘤)等。
2023年,这些孤儿药有望在美国和中国获批
目前,全球已有多款罕见病创新疗法在美国、中国等国家和地区递交上市申请,且大多数已获得优先审评。这意味着,2023年将有一批罕见病新药有望获得加速批准,为罕见病患者带来治疗希望。
在美国,2023年多款新药有望获批用于治疗罕见病,例如:治疗杜氏肌营养不良(DMD)的基因疗法SRP-9001、治疗营养不良性大疱性表皮松解症(DEB)的基因疗法B-VEC、治疗弗里德赖希共济失调症(FA)的Nrf2激动剂omaveloxolone、治疗血友病A的基因疗法Roctavian、治疗肌萎缩侧索硬化(ALS)的反义寡核苷酸疗法tofersen、治疗恶性血癌的干细胞/骨髓移植产品omidubicel、治疗罕见贫血的CRISPR基因编辑疗法exa-cel、治疗全身性重症肌无力的FcRn靶向疗法rozanolixizumab等。
在中国,2023年也有10多款罕见病新药有望获批上市,例如:治疗Alagille综合征的ASBT抑制剂马昔巴特、治疗1型神经纤维瘤病的MEK抑制剂司美替尼、治疗短肠综合征的GLP-2类似物teduglutide、治疗庞贝病的酶替代疗法艾夫糖苷酶α、治疗阵发性睡眠性血红蛋白尿症(PNH)的新一代C5补体抑制剂珂罗利单抗、治疗家族性地中海热的IL-1受体拮抗剂安纳白介素注射液、治疗Wilson病的铜离子络合剂四盐酸曲恩汀薄膜衣片、治疗尿素循环障碍的氮结合剂苯丁酸甘油酯口服液等。
不可否认的是,开发有效的罕见病新药仍面临诸多挑战,如医学和科学层面对许多罕见病的致病原因、发病机理、复杂生物学等方面的理解不够深刻,药物开发方面缺乏有效的生物标志物和动物模型,设计试验方案和招募受试者困难等。道阻且长,行则将至。期待在不久的未来,这些挑战都被一一攻克,让更多罕见病患者拥有改善疾病和生活质量的治疗选择,甚至获得改变命运的机会。
参考资料(可上下滑动查看)
[1] Rare diseases, common challenges. Nat Genet 54, 215 (2022). https://doi.org/10.1038/s41588-022-01037-8
[2] 《Clinical Development Success Rates and Contributing Factors 2011–2020》. Retrieved Feb, 2021, from https://www.bio.org/clinical-development-success-rates-and-contributing-factors-2011-2020
[3] The Next Generation of Rare Disease Drug Policy: Ensuring Both Innovation and Affordability. Retrieved Apr 7, 2022, from https://icer.org/wp-content/uploads/2022/04/ICER-White-Paper_The-Next-Generation-of-Rare-Disease-Drug-Policy_040722.pdf
[4] A Report on Orphan Medicines in the Pipeline. Retrieved Apr 7, 2022, from https://icer.org/wp-https://phrma.org/resource-center/Topics/Medicines-in-Development/Medicines-in-Development-for-Rare-Diseases-2021-Report
[5] CDER Drug and Biologic Accelerated Approvals Based on a Surrogate Endpoint. From https://www.fda.gov/media/151146/download
[6] 新版国家医保药品目录公布 多数药品获得全球最低价. Retrieved Jan 18, 2023, from http://news.cctv.com/2023/01/18/ARTIoCeVDVE8iTodl6THp0Gg230118.shtml
[7]中国国家药监局年度药品审评报告. From https://www.nmpa.gov.cn/yaowen/ypjgyw/index.html
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..