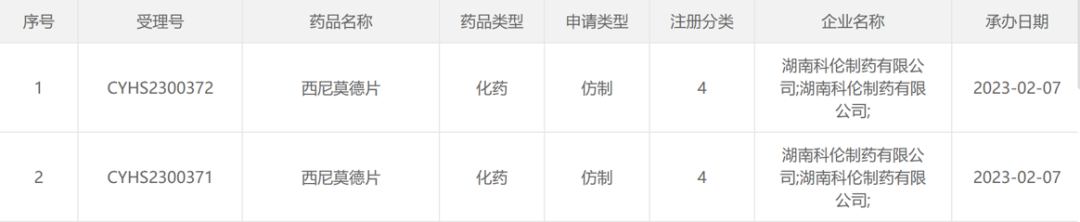
2月7日,湖南科伦制药有限公司递交的「西尼莫德片」4类仿制药上市申请获CDE受理。
西尼莫德(siponimod)是一种新一代选择性1-磷酸鞘氨醇(S1P)受体调节剂,能选择性地与S1P1和S1P5受体结合。当与淋巴细胞上的S1P1亚型受体结合时,siponimod可阻止淋巴细胞离开淋巴结,从而阻止其进入多发性硬化(MS)患者中枢神经系统(CNS),起到抗炎作用。而且,西尼莫德也能进入CNS,直接与其中的特定细胞(少突胶质细胞和星形胶质细胞)上的S1P5和S1P1亚型受体结合,促进髓鞘再生和防止炎症。
2019年3月,诺华原研西尼莫德片(siponimod,Mayzent)被FDA批准用于治疗成人复发型多发性硬化(MS),包括活动性继发进展型多发性硬化(SPMS)、复发缓解型多发性硬化(RRMS)、临床孤立综合征(CIS)。
Mayzent获批的3期临床研究EXPAND结果显示:Mayzent显著降低3个月确证残疾进展风险(与安慰剂相比降低21%,P=0.013;在筛查前2年存在复发活动性患者中,与安慰剂相比降低33%,P=0.0100)。同时,Mayzent显著降低6个月残疾进展风险(与安慰剂相比降低26%,P=0.0058),并将年化复发率降低了55%。同时,Mayzent在包括认知、MRI疾病活动和脑容量损失(脑萎缩)方面也表现出积极的结果。
作为全球首个获批用于治疗SPMS的口服疾病修正治疗(DMT)药物,Mayzent上市后销售额逐年增长。据公司财报,2020年至2022年Mayzent销售额分别为1.70亿美元、2.81亿美元和3.57亿美元。
在国内,原研西尼莫德片(商品名:万立能)于2020年5月被NMPA批准用于治疗成人复发型多发性硬化,包括CIS、RRMS和SPMS。2020年12月,该药顺利通过医保谈判进入国家医保。据悉,西尼莫德进入医保前价格大约为每盒过万元,进入医保报销后每盒患者只需自付2000元左右。
目前,国内布局西尼莫德仿制药的企业并不多,科伦药业是首家递交西尼莫德片仿制药上市申请的企业,大概率有望斩获西尼莫德首仿生产批件。
值得一提的是,近几年科伦药业在仿制药领域的表现可圈可点。2020年至2022年科伦药业获批的仿制药数量分别为15个、17个、19个。而且,2022年科伦药业先后取得溴莫尼定噻吗洛尔滴眼液、注射用头孢曲松钠/氯化钠注射液、琥珀酸曲格列汀片、钆特醇注射液、枸橼酸西地那非口崩片、中长链脂肪乳/氨基酸(16)/葡萄糖(36%)注射液、中长链脂肪乳/氨基酸(16)/葡萄糖(30%)注射液7个品种的首仿,与恒瑞医药并列成为年度"首仿之王"。
除了仿制药,科伦药业在创新药领域表现也不错。据悉,科伦药业有20多个创新药项目进入临床开发,涉及化药、单抗、ADC药物、CAR-T等领域,适应症涉及肿瘤、肝病、心血管、麻醉镇痛、自身免疫等疾病领域。
尤为值得一提的是,2022年科伦药业3次牵手默沙东,三次对外授权交易总金额合计超100亿美元:(1)2022年5月,科伦药业子公司科伦博泰将TROP2靶向ADC药物SKB264在中国以外区域的研发、生产和商业化权益有偿许可默沙东,交易金额包括4700万美元首付款、不超过13.63亿美元的里程碑付款以及产品上市后的净销售额提成;(2)2022年7月,科伦博泰将治疗实体瘤的在研ADC药物(项目B)有偿许可默沙东在全球范围内商业化开发,交易金额包括3500万美元不可退还的首付款,里程碑付款累计不超过9.01亿美元;(3)2022年12月,科伦博泰将管线中7种不同在研临床前ADC候选药物项目以全球独占许可或独占许可选择权形式授予默沙东在全球范围内或在中国大陆、中国香港和中国澳门以外地区进行研究、开发、生产制造与商业化,交易金额包括1.75亿美元不可退还的首付款,以及不超过93亿美元的里程碑付款。对外授权交易从侧面说明科伦药业的创新药实力获得国际认可,其中第三次授权交易再次刷新了我国药企对外授权交易金额记录。
关于召开第七届七次理事会暨会长办公会
各相关单位: 经研究,四川省医..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..认真落实巡视组反馈意见,进一步规范协
按照四川省市场监督管理局党组巡视..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于召开会长办公会的通知
各会长、副会长单位: 根据四川..四川省医药保化品质量管理协会组织召开
2025版《中国药典》将于2025年10月..四川省医药保化品质量管理协会召开第七
四川省医药保化品质量管理协会第七..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..