日前,礼来宣布,美国FDA加速批准了Jaypirca(pirtobrutinib,100mg和50mg片剂)上市,用于既往接受过至少二线系统治疗后(包括布鲁顿酪氨酸激酶(BTK)抑制剂)复发或难治性套细胞淋巴瘤(MCL)成人患者。根据礼来新闻稿,Jaypirca是FDA批准的首个也是唯一一款非共价(可逆)BTK抑制剂。

据了解,Jaypirca是一款高选择性BTK抑制剂,可以在先前使用共价BTK抑制剂(伊布替尼、阿卡替尼或泽布替尼)治疗的MCL患者中重新建立BTK抑制,并扩大靶向BTK途径的益处。
此次FDA对Jaypirca的批准是基于一项名为BRUIN的I/II期临床研究数据,更具体地说是基于120位MCL患者的结果,他们接受一天一次200 mg Jaypirca治疗直到发生疾病进展或产生无法接受的毒性。这些患者曾接受中位3线(范围:1-9)的治疗,其中93%的患者接受过两线或更多个治疗线,所有患者都曾接受过至少1线以上包含BTK共价抑制剂的疗法,疗效的评估是基于独立审评委员会对患者总缓解率(ORR)与缓解持续时间(DOR)的评估。
数据分析显示,患者的ORR为50%(95%CI:41-59),分别有13%与38%的患者达成完全与部分缓解,患者的中位DOR为8.3个月(95%CI:5.7-尚无法评估)。
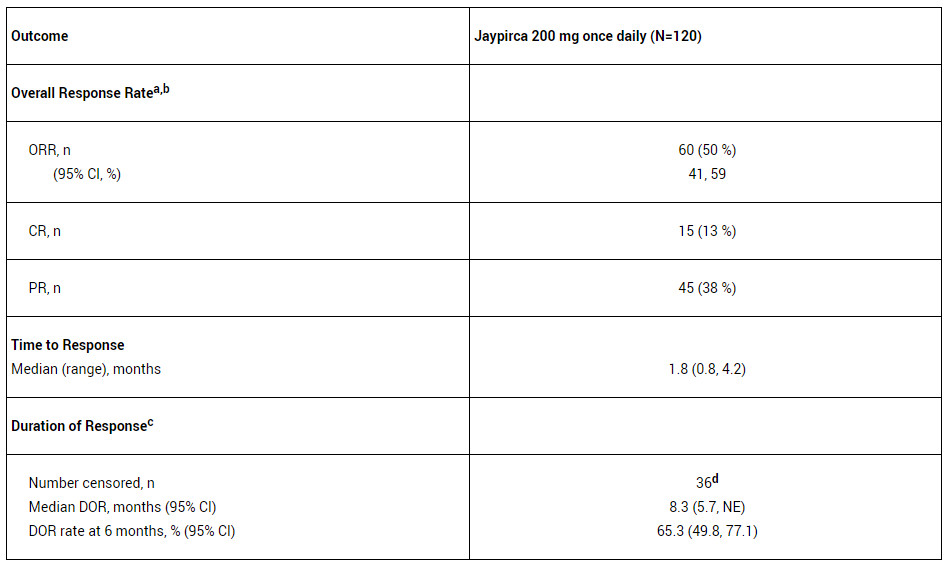
BRUIN试验中接受Jaypirca治疗的MCL患者临床数据图片来源:礼来官网
安全性方面,根据对BRUIN试验当中共583位患有血液肿瘤并接受每日单剂200 mg Jaypirca治疗患者的安全性评估发现,Jaypirca最常见的不良反应(发生于20%或以上患者)包含中性粒细胞数下降、血红蛋白减少、血小板计数减少、疲劳、肌肉骨骼疼痛、淋巴球数降低、瘀青与腹泻等。
另值得注意的是,2022年3月,礼来与信达生物达成合作,后者拥有Jaypirca未来在中国大陆商业化权利的优先谈判权。
截止目前,全球共有5款BTK抑制剂上市,包括强生/艾伯维的伊布替尼(2013年11月上市),阿斯康利的阿卡替尼(2017年10月上市)、小野制药的替拉鲁替尼(2020年3月上市)、百济神州的泽布替尼(2020年6月上市)、以及诺诚建华的奥布替尼(2020年12月上市),早在2021年,Jaypirca就曾启动分别与伊布替尼、阿卡替尼、泽布替尼的头对头三期临床试验。
据弗若斯特沙利文依据前几年数据得出的23.3%的复合增长率分析,BTK抑制剂市场规模在2023年预计将达到129亿美元,在2030年则达到235亿美元。对应的中国市场,BTK抑制剂的市场规模预测将达到26亿美元,2018年-2023年的年复合增长率高达89.2%。
文 | 医谷
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..