近日,美国FDA药物评价和研究中心(CDER)发布了2022年度的新药获批报告(New Drug Therapy Approvals 2022)。
报告显示,这一年里,FDA CDER一共批准了37款新药。获批生物制品类型丰富,涉及单抗、双抗、ADC、TCR疗法、酶替代疗法等。
从过往的数据来看,2013年到2022年,平均每年约有43种新药在FDA CDER获得批准,2022年数量少于以往平均。
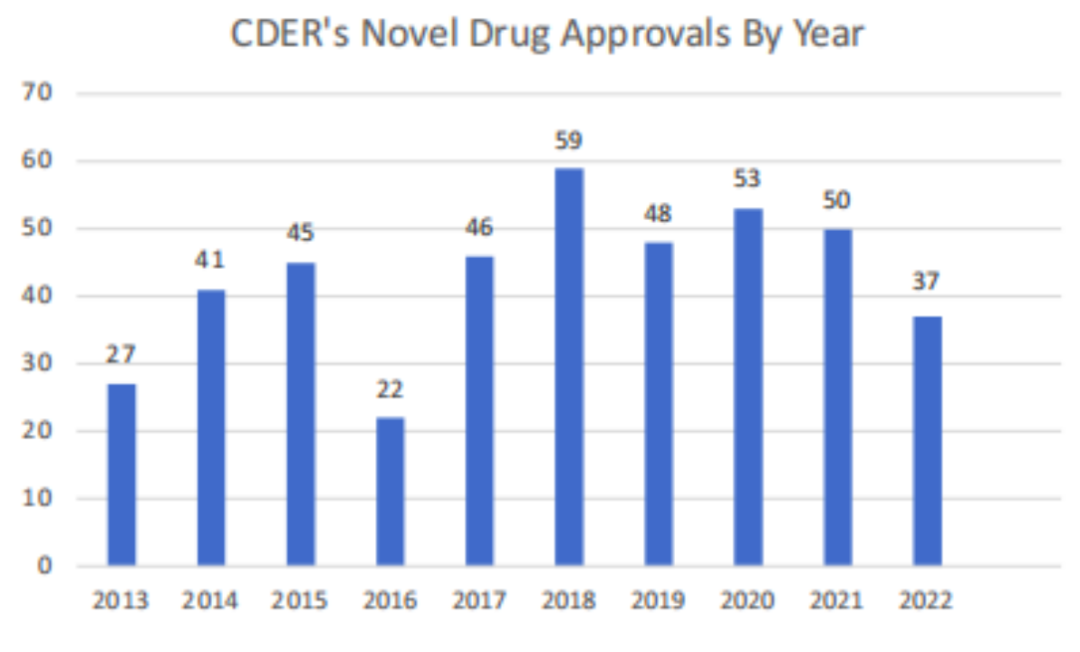
不过,2022年FDA CDER收到的药物申请数量与过去几年相似(且高于历史标准)。报告认为,这表明药物开发领域的创新依然强劲。
值得注意的是,在去年获批的药物中,有20款药物为“first-in-class”疗法,占到了全年获批新药总数的54.1%。报告指出,“first-in-class”新药的占比与去年的54%非常接近,为近十年来的最高值。
另外,2022年FDA批准的基因疗法数量空前,高达4款,多以罕见病治疗为主。其中包括蓝鸟生物的Zynteglo、Skysona,CSL Behring的Hemgenix等。
01 BMS成为最大赢家
2022年,BMS成为FDA CDER新药最大赢家,收获了3款上市新药。分别为3月份获批的纳武利尤单抗+瑞拉利单抗,4月末获批的Mavacamten,以及9月份获批的氘可来昔替尼。
其中,纳武利尤单抗+瑞拉利单抗(PD-1+LAG-3)复方组合中的瑞拉利单抗是继CTLA-4、PD-1/PD-L1之后,全球批准的第3类免疫检查点抑制剂。PD-1和LAG-3联合治疗可激活T细胞,从而引发改善的免疫反应并促进肿瘤细胞死亡。
Mavacamten是一款“first-in-class”的心肌肌球蛋白别构调节剂,用于治疗以心脏过度收缩和心脏舒张充盈受损为内在原因的疾病。它可以通过抑制过度的肌球蛋白-肌动蛋白横桥的形成来降低心肌收缩力。值得注意的是,联拓生物在2020年8月以1.86亿美元获得了该药在中国大陆、香港、澳门、台湾、泰国和新加坡的开发和商业化权益。
氘可来昔替尼是全球首款TYK2抑制剂,用于治疗成人中重度斑块型银屑病,被BMS寄予厚望。它可通过选择性与TYK2蛋白调控结构域结合,使TYK2呈非活性构象,从而抑制TYK2的活性,发挥治疗作用。
除此之外,BMS去年还在欧洲收获了2款新药,在中国也有1款新药上市,可以说创新含量极高。
02 多款药物获得加速批准
报告显示,去年在FDA CDER获批的37款新药中,12款获得快速通道资格,13款获得突破性疗法认定,21款获得优先审评资格(不包括使用优先审评券递交监管申请的药物),6款药物获得加速批准。总计24款药物使用了一种或多种加速审评过程的资格认定。
在报告中,FDA CDER还着重介绍了多款值得关注的扩展适应证批准。其中多项批准,为特定患者群体带来了首款FDA获批疗法。如:
第一三共的Enhertu静脉输注最初于2019年获得批准。2022年,CDER通过加速批准计划批准了Enhertu治疗不可切除或转移性her2低表达乳腺癌患者。
报告介绍,这是第一个被批准的针对HER2低乳腺癌亚型患者的治疗方法,HER2低表达是一个新定义的HER2阴性乳腺癌子集,患者细胞表面有一些HER2蛋白,但不足以被归类为HER2阳性。
Enhertu在2022年被批准用于之前接受过抗HER2方案,不可切除或转移性HER2阳性乳腺癌患者;以及肿瘤有激活HER2突变,之前接受了全身治疗,不可切除或转移性非小细胞肺癌的成人。
此外,报告还介绍了On Target Laboratories公司研发的Cytalux 注射液。该药2021年被批准用于帮助识别卵巢癌病变。2022年,该药物被批准用于在已知或疑似肺癌的成人手术中帮助识别肺结节(肺生长异常)。以及,赛诺菲与再生元合作的Dupixent注射液,此药最初于2017年批准用于特应性皮炎,2022年被批准为治疗嗜酸性食管炎的第一个治疗药物。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..