系统性红斑狼疮(SLE)是一种潜在致死的系统性自身免疫性疾病,临床表现包括大面积的红色皮疹、发热、疼痛,常常导致多器官、多系统损害。SLE多发于15-45岁生育年龄妇女,男女比例约为1:9。据我国流行病学调查报告,SLE患病率为70/10万人,我国大约有患者100万人,全球约有患者500万人。
图片来源:medindia.net
目前,SLE发病机理尚不完全清楚,一般认为与遗传、环境(如病毒、细菌感染)、激素和免疫因素等多种原因导致的免疫失常和自身耐受缺失相关。
SLE尚无法治愈,仅能达到病情缓解,治疗药物主要包括糖皮质激素(泼尼松、氢化可的松、倍他米松)、免疫抑制剂(环磷酰胺)、抗疟药(羟氯喹)及生物制剂等。不过SLE治疗仍存在反应率不足、复发风险高、副作用明显等问题, 亟需新型有针对性的治疗方法。
主要批准上市药物
近年来,SLE新药研发取得了一定的进展,全球监管机构先后批准了几款新药,如葛兰素史克的Benlysta(belimumab,贝利尤单抗)(FDA 2011/03)、阿斯利康的Saphnelo(anifrolumab)(FDA 2021/08)和荣昌生物的泰爱(泰它西普)(NMPA 2021/03)。
01
Benlysta*羟氯喹之后FDA批准的首个SLE新药
葛兰素史克的Benlysta(belimumab,贝利尤单抗)是一款人源化单克隆抗体,能够特异性地与BLyS(B淋巴细胞刺激因子)结合,抑制B细胞(包括自身免疫性B细胞)的存活,并减少B细胞向产生免疫球蛋白的浆细胞分化。2011年3月,Benlysta被FDA批准用于治疗活动性、自身抗体阳性SLE成人患者,成为自1955年羟氯喹获批以来FDA 50多年来批准上市的首个SLE新药。此外,Benlysta还被批准用于5岁及以上SLE儿童患者,以及用于正接受标准治疗的活动性狼疮性肾炎(LN)成人患者。值得一提的是,Benlysta是第一种在美国市场获批用于治疗SLE儿童患者的药物,同时也是FDA批准的第一款治疗LN的药物。而且, Benlysta还获批两种剂型,即静脉注射剂和皮下注射剂。
Benlysta是目前销售额最高的一款SLE药物,2021年已进入10亿美元俱乐部。

在国内,贝利尤单抗(商品名:倍力腾)于2019年7月被NMPA批准用于治疗在常规治疗基础上仍具有高疾病活动的活动性、自身抗体阳性的SLE成年患者,2020年12月被批准用于 5岁及以上SLE患者,2022年2月被批准用于治疗成人活动性狼疮性肾炎。2020年12月,倍力腾进入国家医保,据悉其进入医保前的价格为1976元/支(120mg),进入医保后价格为755元/支(120mg)。
02
Saphnelo*首个I型干扰素受体抗体
阿斯利康的Saphnelo(Anifrolumab)是一种全人源单克隆抗体,与I型干扰素受体(IFNAR)亚基1结合,阻断包括IFNα、IFNβ和IFN-ω在内的所有I型干扰素的活性。而I型干扰素是参与炎症通路的细胞因子,60%-80%的SLE成人患者具有升高的I型干扰素基因标志。临床数据显示,通过靶向I型干扰素受体,Saphnelo治疗显著降低了SLE患者疾病活动度。
2021年8月,Saphnelo被FDA 批准用于治疗正在接受标准治疗的中度至重度SLE成人患者,成为过去10年来FDA唯一批准用于SLE的新疗法,同时也是获批的首款IFNAR拮抗剂。2022年2月,该药在欧盟被批准作为一种附加疗法,用于治疗尽管接受标准治疗但仍有中度至重度、活动性、自身抗体阳性SLE成人患者。
Saphnelo是阿斯利康于2004年从Medarex公司获得。据公司财报,Saphnelo 2021年销售额为8百万美元,2022年前三季度销售额达69百万美元。
目前,Saphnelo还未在国内获批,已于2021年在国内获批临床。
03
泰爱*全球首创双靶向SLE新药
泰爱(泰它西普)是荣昌生物研发的TACI-Fc融合蛋白,能够靶向对B淋巴细胞发育至关重要的两种细胞信号分子:B细胞淋巴细胞刺激剂(BLyS)和增殖诱导配体(APRIL),这使其能够有效地减少B细胞介导的自身免疫反应,可以治疗包括系统性红斑狼疮等在内的多种B细胞介导的自身免疫性疾病。
2021年3月,泰爱被NMPA附条件批准用于常规治疗基础上仍具有高疾病活动的活动性、自身抗体阳性的SLE成年患者。去年12月,泰爱通过降价顺利进入国家医保,大大提升其在全国的可及性。据悉,泰爱进医保前价格为2586元/支,年治疗费用大概26.9万,进医保后单价约为818.8元/支,预计医保降价后年费大概为6-6.5万元。据公司财报,泰爱 2021年销售额为4730万元,进入医保后“以价换量”效应非常明显,泰爱与HER2靶向ADC维迪西妥单抗这两款产品2022年上半年的销售额就远超过2021年全年。
主要在研药物格局
根据调研,目前全球还有多款在研SLE新药,整体来看,在研SLE类型多样,包括化药、单抗、双抗等。在研SLE新药的作用靶点也非常多元化,涉及BTK、CRBN、TYK2、S1P1、IFNRα、CD20、CD38、BDCA2等,具体药物信息详见下表。
研发进度上,渤健的血液树突状细胞抗原2(BDCA2)靶向单抗BIIB059进展较快,已进入III期临床。天广实生物的MIL62、上海药物研究所的马来酸蒿乙醚胺、以及BMS和安进等多款产品均已进入II期临床。我国药企在SLE领域进展相对较慢,大多在研新药处于I期临床。
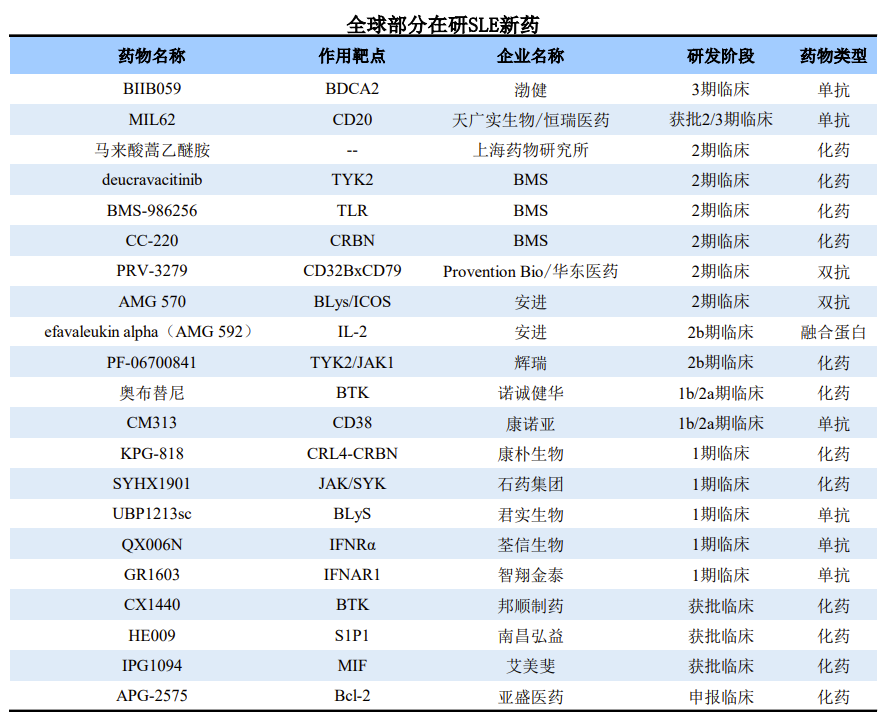
来源:公开资料
根据调研,2022年以来,多款SLE新药临床研发取得积极结果。
1月
渤健生物
渤健研发的靶向BDCA2的全人源化IgG1单克隆抗体BIIB059在国内获批临床。2020年公布的其治疗SLE的2期临床试验LILAC结果显示:接受BIIB059皮下注射治疗的患者在第24周时疾病活跃总关节计数显著减少,达到了试验的主要终点,且研究中大多数不良事件为轻度或中度。
6月
BMS
BMS在欧洲风湿病协会联盟(EULAR)2022年大会上公布deucravacitinib治疗中度至重度SLE的2期PAISLEY研究取得阳性结果:治疗第32周,与安慰剂组相比,deucravacitinib 3mg BID组、6mg BID组达到SRI-4应答的患者比例显著增加(deucravacitinib 3mg BID组:58.2%,p=0.0006;deucravitinib 6mg BID组:49.5%,p=0.0210;安慰剂组:34.4%)。而且,所有deucravacitinib组的SRI-4应答均持续至第48周。
9月
Georg Schett教授团队
德国Georg Schett教授团队等在Nature Medicine期刊发表研究论文,报告5名难治性SLE患者经抗CD19 CAR-T细胞治疗后,所有患者病情得到改善,在长达17个月的随访中未出现复发,并且均实现了无药物缓解。
11月
康朴生物
康朴生物在美国风湿病学会(ACR)年会上公布的KPG-818治疗SLE的1b期临床研究结果显示:患者口服KPG-818胶囊耐受良好,不良反应多为一级或二级。PK研究显示良好的剂量-暴露量相关性,血药浓度在7天内达到稳态。同时,KPG-818有显著的免疫调节功能,包括诱导Aiolos的降解、B细胞耗竭、pDC的下调和Treg的上调等等。而KPG-818是康朴生物设计开发的新一代口服小分子蛋白质泛素化降解药物,属于CRBN E3泛素连接酶复合物(CRL4-CRBN)调节剂。
国内企业布局情况
我国是SLE患者大国,据据弗若斯特沙利文预计,2030年全球SLE患病人数达855.2万人,而我国就约109.5万人。然而,目前我国仅批准两款SLE生物制剂,即倍力腾(贝利尤单抗)和泰爱。不过,我国药企如恒瑞医药、石药集团、君实生物等积极布局SLE药物,自主研发出多款SLE新药。
君实生物是国内首家申报抗BLyS靶点单克隆抗体药物的中国企业,其UBP1213sc于去年11月在国内获批开展治疗SLE的临床试验,目前处于1期临床。智翔金泰和荃信生物均布局了抗IFNAR1单克隆抗体,其中智翔金泰自主研发的GR1603是国内企业首家进入1期临床试验的抗IFNAR1单克隆抗体。康诺亚独立自主研发的CD38抗体CM313于今年4月在国内被批准开展治疗SLE的临床试验。
除了自主研发,我国药企如华东医药还积极从其他企业引进SLE新药。2021年2月,华东医药与美国Provention Bio达成独家临床开发及商业化协议,获得PRV-3279治疗SLE,以及预防或降低基因治疗的免疫原性两个适应症在大中华区的权益。PRV-3279是一种靶向B细胞表面蛋白CD32B和CD79B的人源化双抗体,通过结合CD32B和CD79B受体,触发对B细胞功能和自身抗体产生的抑制,从而在不引起B细胞耗竭的情况下调节B细胞。今年1月,该药启动治疗SLE的2a期临床研究PREVAIL-2。
总结
据弗若斯特沙利文预计,2030年全球SLE治疗药物市场规模预期达169亿美元,其中生物制剂市场规模达143亿美元,我国市场有望达到43亿美元,其中生物制剂达32亿美元。从目前几款SLE生物制剂的销售额来看,目前全球及国内SLE市场远未饱和,仍有待进一步挖掘,期待未来可以有更加高效、便捷的SLE新药获批上市,造福广大SLE患者。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..