2018年5月,我国五部委联合发布的《第一批罕见病目录》成为目前国内罕见病的主要界定标准,共收录121种疾病。
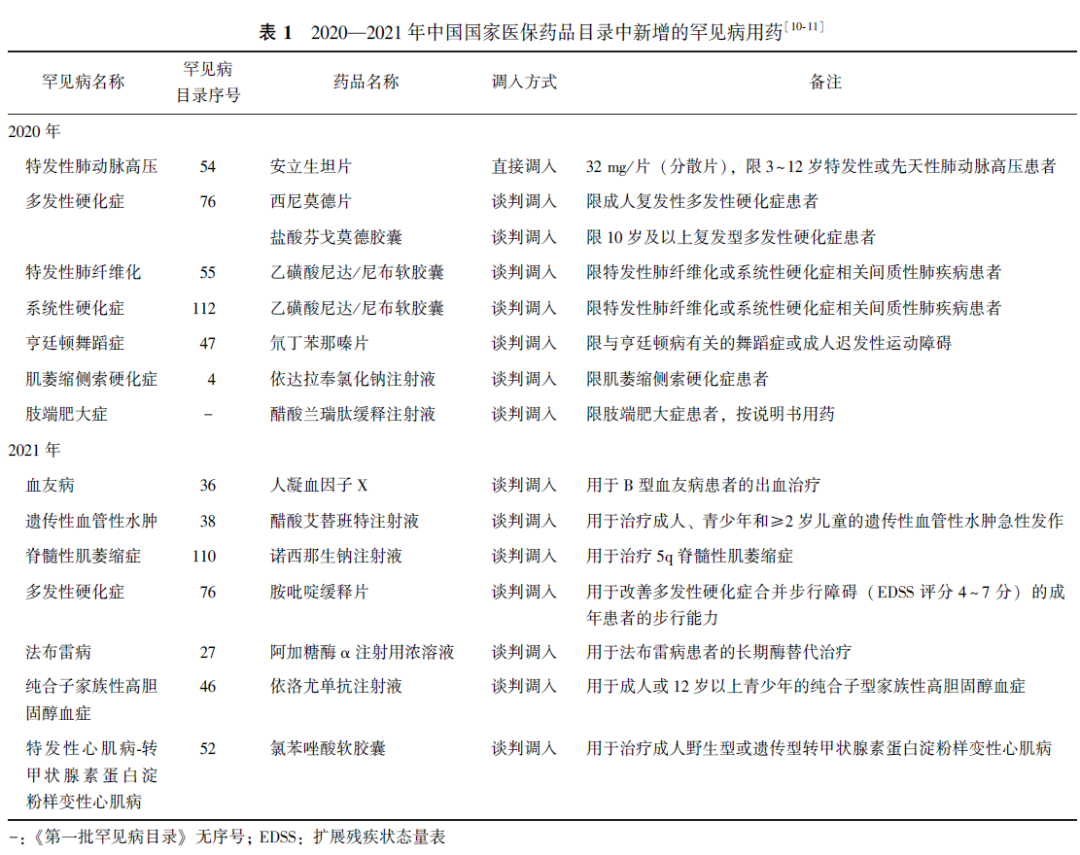
14种罕见病药纳入医保
在国家医疗保障局、人力资源和社会保障部印发的《国家基本医疗保险、工伤保险和生育保险药品目录》中,2020年和2021年各新增7种罕见病治疗药物(表1),加之此前医保目录已覆盖的40余品类罕见病药物,目前纳入医保目录的药物已达62品类,其中甲类15种、乙类47种。

针对部分全国人大代表提出的“关于将罕见病用药纳入医保目录”的建议,国家医保局发文回复称,目前符合条件的罕见病药品已全部被纳入基本医疗保险支付范围,部分远超基金和患者承受能力的特殊罕见病用药尚无法被纳入基本医保支付范围。
13种罕见病药物在国内获批上市
2020—2021年,共有13种罕见病治疗药物在国内获批上市(表2)。
在以上罕见病用药中,拉那利尤单抗(达泽优)用于预防遗传性血管性水肿(HAE)。拉那利尤单抗可通过抑制血浆激肽释放酶而阻止缓激肽的生成,减少水肿发作次数,预防喉头水肿导致的窒息,成为继达那唑之后国内第二款针对HAE的特效药物。
在转甲状腺素蛋白淀粉样变性的治疗方面,两款药物获批上市,氯苯唑酸软胶囊(维万心)用于治疗成人野生型或遗传型转甲状腺素蛋白淀粉样变性心肌病,该药物是全球唯一获批针对转甲状腺素蛋白淀粉样变性心肌病的治疗药物,可减少心血管死亡及其他不良事件的发生;而氯苯唑酸葡胺软胶囊(维达全)用于治疗转甲状腺素蛋白淀粉样变性多发性神经病。
多种罕见病药物纳入拟优先审评品种
除已上市的药物外,部分罕见病治疗药物被纳入拟优先审评品种。
2020年6月10日,中国国家药品监督管理局(NMPA)药品审评中心(CDE)公示,拟治疗脊髓性肌萎缩症的SMN2基因剪接调节剂risdiplam口服溶液用粉末的新药上市申请将纳入优先审评。
9月29日,CDE公示,2款新药纳入优先审评:其中一款为迪妥昔单抗注射液,用于治疗多种神经母细胞瘤;另一款为布鲁顿氏酪氨酸激酶抑制剂(泽布替尼胶囊),此次纳入优先审评的适应证为成人华氏巨球蛋白血症。
10月21日,CDE网站公示,CD38单克隆抗体达雷妥尤单抗注射液的两项上市申请被纳入优先审评品种,公开资料显示,达雷妥尤单抗是全球首个获批上市的靶向作用于CD38的全人源单克隆抗体,早先该药已在中国获批单药治疗多发性骨髓瘤成年患者,本次提交的是达雷妥尤单抗与来那度胺和地塞米松联合用药或与硼替佐米和地塞米松联合用药,治疗既往至少接受过一线治疗的多发性骨髓瘤成人患者。
10月28日,CDE公示,布罗索尤单抗注射液3项新药上市申请拟纳入优先审评,分别对应10 g/L、20 g/L和30 g/L 3种不同规格,拟开发适应证均为肿瘤相关骨软化症。
2021年1月22日,CDE公示将注射用司妥昔单抗纳入优先审评,适应证为人类免疫缺陷病毒阴性和人类疱疹病毒8阴性的多中心卡斯特曼病成年患者,该药可通过阻断白细胞介素-6介导的炎症通路抑制异常免疫细胞的产生。
8月9日,CDE将维托拉生注射液纳入优先审评审批,适应证为肌营养蛋白的基因缺失经验证可通过 53 号外显子跳跃治疗的杜氏肌营养不良,该药为一种反义寡核苷酸药物,通过靶向肌营养不良蛋白前体mRNA发挥作用。
参考资料:
[1]何山,高仕奇,何欣悦,等. 中国罕见病领域新进展(2020—2021)[J]. 协和医学杂志,2022,13(1):39-45. DOI:10.12290/xhyxzz.2021-0248.
关于召开第七届七次理事会暨会长办公会
各相关单位: 经研究,四川省医..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..认真落实巡视组反馈意见,进一步规范协
按照四川省市场监督管理局党组巡视..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于召开会长办公会的通知
各会长、副会长单位: 根据四川..四川省医药保化品质量管理协会组织召开
2025版《中国药典》将于2025年10月..四川省医药保化品质量管理协会召开第七
四川省医药保化品质量管理协会第七..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..