据 Insight 数据库 统计,本周(7月 18 日 - 7 月 23 日)全球共有 23 款创新药(含改良新)研发进度推进到了新阶段,少于以往。其中包括 2 款首次获批上市,6 款首次申报上市,5 款首次启动临床。
Insight 本周将继续摘取国内外部分重要进展做简单介绍。
国内创新药进展
国内方面,本周共有 22 款创新药研发进度推进到了新的阶段,大多处于早期临床开发阶段。
本周国内首次申报临床的创新药
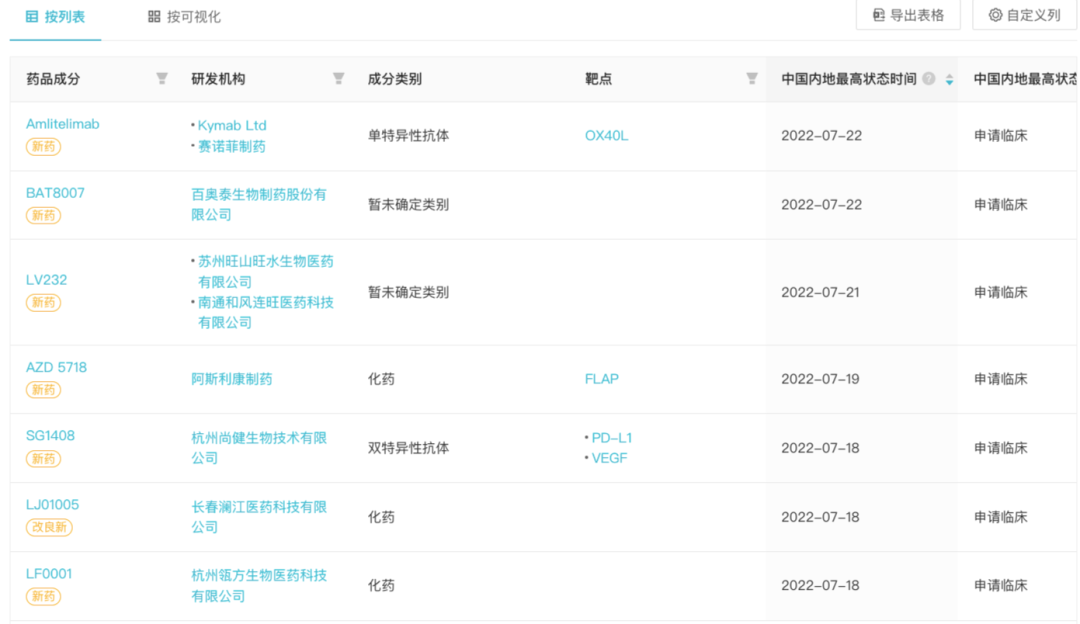
* 筛选依据:中国最高进度进展时间 7 月 18 日 - 23 日
数据来自 Insight 数据库网页版(http://db.dxy.cn/v5/home/)
国内新药获批
第 10 款 PD-1 单抗获批上市,来自乐普生物
7 月 22 日,乐普生物的 PD-1 单抗「普特利单抗」获 NMPA 批准在国内上市,用于既往接受一线及以上系统治疗失败的高度微卫星不稳定型(MSI-H)或错配修复缺陷型(dMMR) 的晚期实体瘤患者。自此,国产第 8 款、也是国内第 10 款 PD-1 单抗正式登场,本就激烈的 PD-(L)1 领域竞争愈发白热化。>>戳此回顾受理号审评历程
国内 PD-1 单抗竞争现状
普特利单抗(研发代号:HX008)是 2018 年乐普生物收购泰州翰中而获得的 PD-1 产品,属于差异化设计的人源化单克隆抗体,在 IgG4 的 Fc 引入了 S254T、V308P、N434A 突变以延长半衰期。
据 Insight 数据库显示,普特利单抗于 2017 年 9 月在国内首次获批临床,2018 年 1 月首次公示临床试验,并于 2021 年 7 月首次申报上市。除了本周获批的 MSI-H/dMMR 实体瘤外,另一项仍在上市申报中的适应症为二线及以上晚期黑色素瘤,相信离获批也不会太远。此外普特利单抗还在开发包括胃癌、非小细胞肺癌、乳腺癌在内的多个癌种,当前已经启动了 19 项临床,胃癌适应症进展最快,有望成为下一个申报上市的适应症。
本次获批主要是基于一项多中心、开放、II 期临床研究,该研究的主要研究终点是独立影像学数据委员会(IRC)根据 RECIST1.1 评估的客观缓解率(ORR)。
截至 2021 年 12 月 4 日,本研究共入组 100 名经组织学确诊的晚期实体瘤患者且中心实验室确认为 MSI-H/dMMR,患者接受本品 200 mg 静脉滴注,每 3 周给药一次(Q3W)。ITT 人群的中位随访时间为 22.5 个月,在 ITT 人群中,ORR 为 49.0%(95%CI:38.86%,59.20%),9 例完全缓解,40 例部分缓解;既往三药(氟尿嘧啶类、奥沙利铂和伊立替康)治疗失败的结直肠癌亚组中,ORR 为 50.0%(95%CI:31.30%,68.70%)。
研究结果表明,普特利单抗单药治疗既往经标准治疗失败的不可切除或转移性的 MSI-H/dMMR 晚期实体瘤患者安全有效,达到临床预期终点,患者能够从治疗中显著获益。该项临床研究结果于 2021 年美国临床肿瘤学会(ASCO)年会上首次公布。
国内新药进入 III 期临床
治疗流感,青峰医药 1 类新药启动 III 期临床
7 月 20 日,青峰医药的 1 类新药 GP-681 片启动了 III 期临床,针对流感病毒感染(临床试验登记号:CTR20221824)。
GP-681 片是一种全新作用机制的核酸内切酶抑制剂,2020 年 4 月 8 日首次在国内申报,同年 8 月首次启动临床,目前已经围绕甲型流感和乙型流感开展了 4 项临床试验。
已完成的 GP-681 片 Ⅰ 期临床研究显示,GP-681 片最低剂量(20mg)在健康人体内 C24 符合研究最初预定的血药浓度,且研究中无 2 级及以上毒副反应发生,表明 GP-681 片抗病毒活性和安全性均良好,具有以较低剂量达到治疗效果的潜力。
国内新药启动临床
1、齐鲁制药:新冠口服药 QLS1128 缓释片首次登记临床试验
据 Insight 数据库监控,齐鲁制药本周刚刚登记了一项针对 COVID-19 的临床试验(ClinicalTrials.gov 登记号:NCT05458076),在健康受试者评价 QLS1128 缓释片联合利托那韦的安全性、耐受性及药代动力学。根据联用方案及适应症推测,QLS1128 很可能为 3CL 蛋白酶抑制剂。
这是齐鲁制药开发的首款针对新冠的治疗药物,标志着这家国内制药巨头也已经开始切入新冠赛道。
3CL 蛋白酶属于半胱氨酸蛋白酶,是新型冠状病毒复制必须的关键蛋白酶。由于辉瑞 Paxlovid 的成功,当前在全球新冠口服药的开发中,3CL 蛋白酶抑制剂是一大热门方向。
据 Insight 数据库显示,当前中国企业至少有 12 个同靶点新冠项目在研,2 款进展最快的分别是先声药业的 SIM0417 和前沿生物的 福布特韦 。先声药业的 SIM0417 在 2021 年 11 月引进自上海药物所,今年 5 月份就启动了联用利托那韦的 II/III 期临床。
2、科兴制药:新冠口服药 SHEN26 首次启动临床
7 月 22 日,科兴制药宣布 RdRp 抑制剂 SHEN26 首次在国内启动临床。
这一项目来自于 2022 年 2 月科兴制药与深圳安泰维生物医药有限公司的合作。在全球范围内,安泰维将其取得的或持有的 SHEN26 知识产权独占许可、后续研发权利及商业化权益转让给深圳科兴。
SHEN26 是一款广谱、强效的新型冠状病毒聚合酶 (RdRp) 抑制剂,可以通过抑 制病毒核酸合成达到抗病毒效果,对不同新冠病毒变异株(野生株、Alpha、Beta、 Delta、Omicron)均有高效的体外抑制活性。
体外抗病毒实验数据显示,SHEN26 对 Omicron 变异株 EC50 为 13nM,抑制活性 是 Remdesivir 的 103 倍;
体内药效实验显示,50 mg/kg 的 SHEN26 与 200 mg/kg 的 Molnupiravir 抗新冠病毒效果相当,在被新冠病毒感染的 K18-hACE2 小鼠模型中, SHEN26 可显著降低肺组织病毒滴度,改善肺部病变,对新冠病毒导致的组织损伤 具有明显的改善作用。
安全性结果提示,SHEN26 存在脱靶副作用的风险较低,致畸、致突变等研究 结果为阴性,具有较高的治疗指数和良好的安全性。
国内获批临床新药
1、辉瑞 CDK2 抑制剂获批临床
7 月 19 日,辉瑞制药的高选择性 CDK2 抑制剂 PF-07104091 首次在中国获批临床。辉瑞持续深耕 CDK 家族靶点,围绕细胞周期不同环节,持续挖掘 CDK2/4 靶点潜力,和 CDK4/6 抑制剂哌柏西利、ER 靶向 PROTAC 等重要产品打配合,巩固在乳腺癌领域的地位。
PF-07104091 的国内 IND 批准也是辉瑞继哌柏西利、CDK4 抑制剂 PF-07220060 之后在中国区域的进一步深入布局。据 Insight 数据库显示,早在 2020 年 8 月辉瑞已经在美国启动了这款新药的临床试验。
2021 年 10 月,辉瑞在 Cancer Cell 上发文揭示了哌柏西利获得性耐药的机制主要源于 CDK2 的激活,这也是开发 PF-07104091 的理论基础之一。在目前已登记的临床试验中,辉瑞探索了 PF-07104091 联合哌柏西利治疗多种实体瘤,包括三阴乳腺癌、小细胞肺癌、卵巢癌,以及联合 CDK4 抑制剂 PF-07220060 治疗乳腺癌的初步疗效。
年初公布的临床数据显示,作为 CDK4/6 抑制剂耐药后的后续疗法,该药已经初步表现出良好的疗效和安全性。已入组的 2 名既往接受过 CDK4/6 抑制剂和内分泌疗法(ET)治疗的 HR+/HER2- 乳腺癌患者在 PF-07104091 单药治疗后达到了 PR,其中一名患者在治疗 8 个月后,肿瘤缩小了 54%,另一名患者在治疗 9 个月后,所有靶病灶缩小了 100%。
辉瑞表示,该试验还将入组三阴性乳腺癌 (TNBC)、铂耐药卵巢上皮癌(EOC)、小细胞肺癌(SCLC)和非小细胞肺癌(NSCLC)患者。这些对 CDK4/6 抑制剂反应不佳的瘤种可能是 CDK2 抑制剂的潜在治疗方向。推测这些肿瘤通过激活 CDK2 途径绕过 CDK4/6 建立了细胞周期调控机制,从而对 CDK2 抑制剂高度敏感,例如 TNBC,肿瘤通常表现出 Rb 表达缺失或 CCNE 扩增,在临床前试验中对 CDK4/6 抑制剂反应不佳,但对 CDK2 抑制剂敏感。
2、华奥泰:首款国产 IL-36R 抗体获批临床
7 月 20 日,华奥泰的 IL-36R 单抗 HB0034 注射液的临床试验申请获默示许可(受理号:CXSL2200191)。
HB0034 为靶向 IL-36R(白介素-36 受体)的人源化 IgG1(免疫球蛋白 G1)型单克隆抗体,能特异性结合 IL-36R,阻断 IL-36 炎症通路信号。
HB0034 与 IL-36R 结 合竞争性阻断受体激动剂(IL36α,β 和 γ)与 IL-36R 的结合,下调下游促炎信号 通路和促纤维化信号通路,抑制上皮细胞/成纤维细胞/免疫细胞介导的炎症反应,从 2 而减少炎性疾病/皮肤疾病(包括泛发性脓疱型银屑病、炎性肠病、系统性红斑狼疮、 纤维化疾病)中驱动致病的细胞炎症因子的释放,达到控制疾病的目的。
临床前研究证明 HB0034 具有显著抑制咪喹莫特(IMQ)诱导的食蟹猴皮肤红斑、皮屑及增厚的银屑病样症状,说明其在体内具有较强的生物学活性。同时,通过对 Fc 段进行改造,在一定程度上减弱甚至消除了 HB0034 的 ADCC 和 CDC 功能,安全耐受性良好,具有作为抗炎制剂进行开发的极大潜质。
据 Insight 数据库显示,目前尚无抗 IL-36R 类药物上市,研究进展较快的是 Boehringer Ingelheim 的 BI655130 (Spesolimab) 和 AnaptysBio 的 ANB019 (Imsidolimab),当前正在泛发性脓疱 型银屑病 (GPP)、掌趾脓疱病 (PPP)、特异性皮炎 (AD)、溃疡性结肠炎、克罗恩病、化 脓性汗腺炎等疾病中开展临床试验。
境外创新药进展
本周境外共有 10 款新药(含改良新)研发进度推进到新阶段,此外,一些重磅新药在不同地区、针对不同适应症的上市申报和获批也颇受关注。
本周境外发生进展的新药
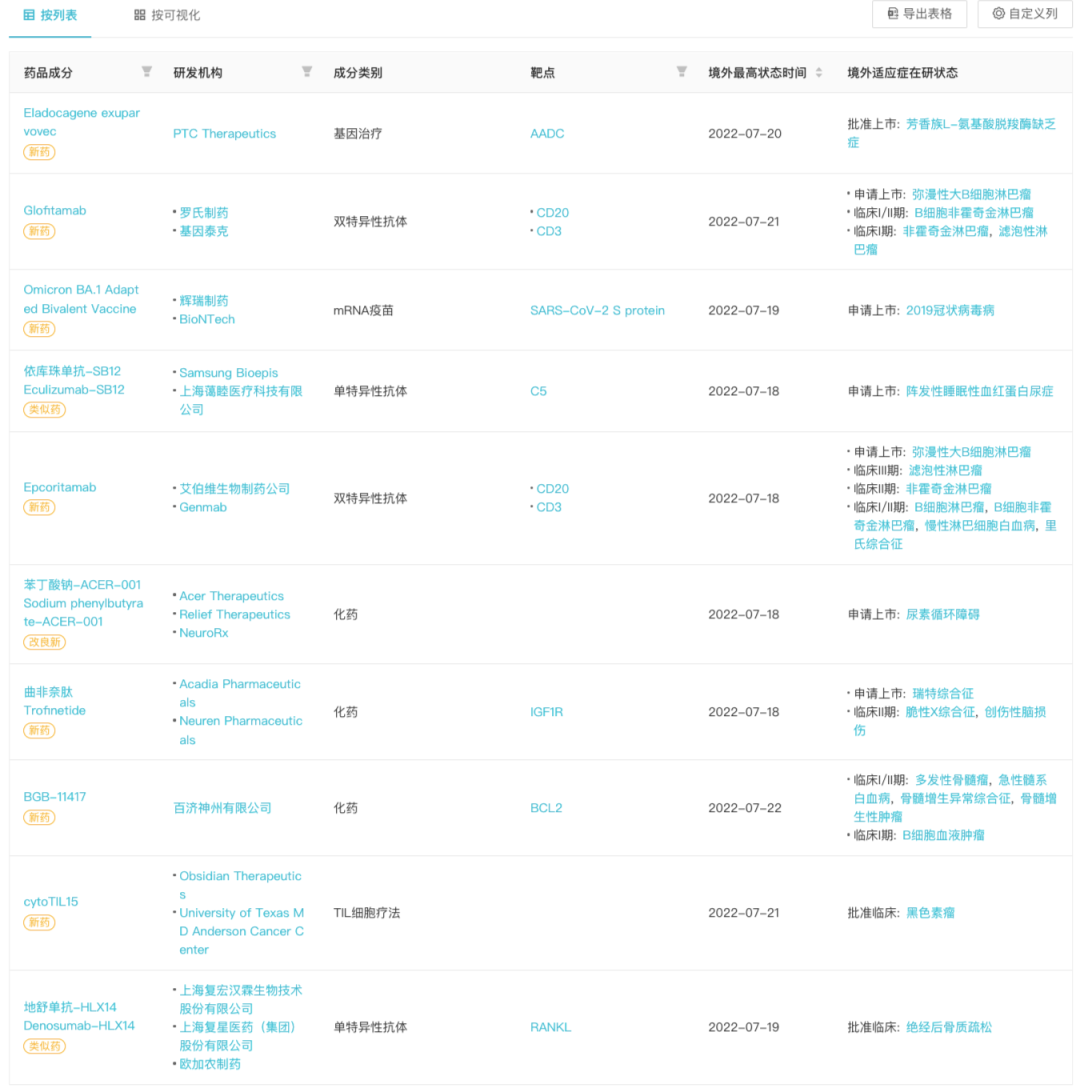
来自:Insight 数据库网页版(http://db.dxy.cn/v5/home/)
(点击放大,可查看大图)
新适应症获批
1、第一三共/阿斯利康 DS-8201 欧盟获批新适应症
7 月 19 日,阿斯利康和第一三共联合宣布,Trastuzumab deruxtecan(DS-8201/Enhertu)在欧盟被批准用于既往接受过一种或多种基于抗 HER2 治疗方案的 HER2 阳性转移性乳腺癌患者。
Trastuzumab deruxtecan 是阿斯利康和第一三共联合开发的靶向 HER2 的抗体药物偶联物,由人源化 HER2 单抗通过可裂解四肽连接子与新型的拓扑异构酶 I 抑制剂相连接构成。
当前 Trastuzumab deruxtecan 已在美国、日本、欧盟获得 HER2 阳性转移性乳腺癌、胃癌及胃食管交界处癌的二线和末线疗法资格。此前,也已经向 CDE 提交上市申请,用于既往接受过一种或多种基于抗 HER2 治疗方案的 HER2 阳性转移性乳腺癌患者。
此次获批基于一项 DESTINY-Breast 03 研究。结果显示,在 524 例随机分组的患者中,T-DXd 组和 T-DM1 组 12 个月无进展生存率分别为 75.8% 和 34.1%(HR = 0.28;95%CI,0.22-0.37;P < 0.001)。
据 Insight 数据库显示,当前 trastuzumab deruxtecan 还在拓展针对非小细胞肺癌、结直肠癌和尿路上皮癌等其他癌种的开发。
2、芦可替尼获 FDA 批准治疗白癜风
7 月 19 日,Incyte 公司宣布外用 JAK1/2 抑制剂芦可替尼乳膏(ruxolitinib)获 FDA 批准新增适应症,用于 12 岁以上的白癜风患者。这是 FDA 批准的首款帮助非节段性白癜风患者恢复皮肤色素的疗法。
该项批准基于关键 III 期临床 TRuE-V2 研究数据。在该项研究中,芦可替尼达到了所有主要和关键性次要终点。在第 24 周,29.9% 接受芦可替尼乳膏治疗的患者达到面部白癜风症状改善至少 75% 的标准,而对照组仅为 12.9%;15.4% 的患者症状改善超过 90%,而对照组仅为 1.9%。
3 家外企半年报发布
本周,诺华、强生、罗氏 3 家 MNC 发布了 2022 年上半年业绩并更新了最新管线进展。值得关注的是,罗氏还与财报一同公布了 CEO 更迭信息、诺华则透露了合作百济神州的替雷利珠单抗在海外的进一步申报计划……
认真落实巡视组反馈意见,进一步规范协
按照四川省市场监督管理局党组巡视..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于召开会长办公会的通知
各会长、副会长单位: 根据四川..四川省医药保化品质量管理协会组织召开
2025版《中国药典》将于2025年10月..四川省医药保化品质量管理协会召开第七
四川省医药保化品质量管理协会第七..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..学习传达中央八项规定精神专题会议
2025年4月22日,协会党支部组织召..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..