Keytruda迈出重要一步
从实验室产品到潜在药物
2003年最早由荷兰Organon公司的科学家开发,当时的研发初衷并非用于肿瘤治疗,意在寻找一款治疗自身免疫病药物,拟通过激活PD-1受体,抑制人体自身的免疫反应,达到治疗目的。
在无数次尝试之后,研发团队未能找到激活PD-1的靶标,却发现了抑制免疫检查点PD-1活性的潜在产品,于是转而开始了癌症免疫治疗的实验室探索。
2006年Organon的研发团队与LifeArc合作,进行产品人源化开发。LifeArc使用CDR移植技术从Organon的小鼠抗体中生成人源化的临床候选药物,将创新靶标产品转化为一款高活性、专一性的人源化单克隆抗体。
Keytruda迈出了从实验室产品到潜在治疗药物的重要一步。此时,它的开发前景一片光明,让人充满期待。
也得益于这次合作,LifeArc获得了丰厚回报,Keytruda上市两年后,2016年默沙东支付给LifeArc高达1.15亿英镑的特许权使用费。
Keytruda折戟沉沙?
然而,新药研发的道路从来都不是一帆风顺,即使是耀眼如Keytruda的超级重磅产品,它一度无人问津,面临被转手的命运。
2007年荷兰Organon公司被收购,并入先灵葆雅。两年后2009年默沙东以411亿美元将先灵葆雅归入麾下,Organon的产品也一并被默沙东收入囊中,其中就包含这一款抗PD-1产品——Keytruda。
很可惜,起初这个项目并未引起默沙东重视,一度寻求买家易手,由于各种原因交易未能达成,产品估值低到可以忽略不计,项目暂停、团队解散,研究陷入停滞。
2010年,事情出现了转机。
百时美施贵宝的首款免疫检查点抑制剂Ipilimumab(Yervoy®)用于难治性转移性黑色素瘤的临床III期试验,获得了突破性进展,研究结果发表在当年的《新英格兰医学杂志》(NEJM)上。与此同时,百时美施贵宝收购的另一款免疫检查点抑制剂Nivolumab(Opdivo®)也在临床上显示出了积极效果。
一石激起千层浪,免疫检查点治疗的突破性结果,给人类对抗致命癌症带来了曙光,也让默沙东意识到了PD-1的潜力。
默沙东管理层迅速做出反应,重启了这款PD-1产品,代号为MK-3475,紧急组建团队,并赶在当年年底2010年12月向FDA递交了申请,启动临床。
然而,百时美施贵宝的Nivolumab,即Keytruda的同类竞品Opdivo,早在2006年就向FDA递交了材料。
也就是说,默沙东比竞争对手晚了四年!
“时间就是金钱”,尤其是竞争激烈的制药巨头间,不用说晚四年,晚四个月都是迥然不同的局面。
默沙东“亡羊补牢”还来得及吗?
最后的答案我们已经知晓。
Keytruda奋起直追
默沙东不但没有晚,Keytruda比Opdivo还提早了三个月获得FDA批准,Keytruda在美国批准的时间是2014年9月,Opdivo则是2014年12月。

(2014年9月4日FDA批准Keytruda,来源:FDA)
在落后的情况下,默沙东是如何奋起直追,最终抢占先机的呢?
3.1
一次最大的临床I期试验
一些早期试验结果显示,Keytruda在黑色素瘤患者中有更高的响应,考虑到百时美施贵宝的Yervoy是针对难治性黑素瘤患者,且获得了令人瞩目的成果。2011年Keytruda临床I期启动,默沙东决定扩充临床I期研究队列,并集中于晚期黑色素瘤患者。
根据默沙东临床研究负责人回忆:“(这个临床1期试验)最终扩大为包括655名患有转移性黑色素瘤的患者和相似数量的肺癌患者,成为肿瘤学中曾经做过的最大的一次临床I期试验。”
我们知道通常情况下,临床I期试验研究对象为健康受试者,根据我国《药品注册管理办法》规定,受试者最低例数20-30例。虽然这个例数不固定,会根据统计设计或各国法规具体调整,但最多也是百例上下。
Keytruda的这次临床I期试验不仅纳入了患者,而且受试者数量也达到了前所有为的规模。
很显然,默沙东做了一个非常大胆的尝试,而在当时看来,没人知道结果如何。事实证明,这个大胆的尝试成功了!充足的临床I期研究数据获得了让人满意的结果,这为后续得到FDA认可,获得快速审批奠定了坚实基础。
3.2
企业与监管部门的共赢
2012年FDA拟实施一个新的监管机制,旨在加速开发及审查治疗严重的或威胁生命的疾病的新药,称之为“突破性疗法资格”(Breakthrough Therapy Designation,BTD)。

(关于BTD,来源:FDA)
默沙东在第一时间获得了这一消息,并在2013年1月份收到了FDA授予Keytruda的BTD资格。
这个资格,不仅意味着FDA对Keytruda潜力的认可,还意味着在研究的早期阶段FDA就会介入指导,让新药研发少走弯路。
而且在整个审查过程中,申办者与审查人员能有更多的密集交流,从而减少申报企业与监管部门的误差,进一步提高审评效率。
正如默沙东副总裁所说:“监管机构真的希望患者快速获得重要的创新药物。”
在Keytruda的审批阶段,默沙东的开发团队与FDA密切沟通,频繁开会讨论,他们只为同一个目标:满足临床需求,让患者尽快从创新药物中获益。
在整个审评过程中,FDA也没有降低标准、放松监管,只是全力帮助默沙东了解监管机构的需求,通过密集指导和滚动审查,确保开发团队更有效的达成研究目标。
可以说Keytruda的成功,是默沙东与FDA的共赢,是企业与监管部门的共赢。
3.3
商业、伦理与科学的博弈
默沙东管理层决定,在Keytruda的研究早期从黑色素瘤着手,并且采用生物标志物检测,从有应答的人群中筛选受试者。这个决定立即遭到了股东和分析师的极力反对。
从商业角度考虑,黑色素瘤的潜在市场有限,而且采用生物标志物选择受试者,进一步把应用范围受限于亚组人群,而不是整个人群。
在伦理上也是个挑战,在接受治疗前,患者要先做生物标志物检测,再根据测试结果决定用药。这就意味着一些阴性的晚期癌症患者,在没有其他用药选择的情况下,也无法入组接受治疗。
另一个饱受争议的点在于,当时的生物标志物还不完美,它可能将一些有潜在获益的患者排除在研究之外。
然而,默沙东研究实验室的负责人则坚持认为:“早期研究中的决定因素应该基于科学,而非商业考量。”
从科学角度考虑,开发团队觉得,采用生物标志物能更精准的定义临床试验的目标人群,筛选出更高响应的受试者。不仅确保了临床试验的可行性,增加了研究结果的确定性,也提高了临床试验的研发效率。
3.4
默沙东选择了——科学
最终的结果也从正面验证了这一选择,后续扩大瘤种的临床试验陆续开展,更多令人振奋的研究结果发布,当2016年Keytruda用于一线治疗非小细胞肺癌临床III期的研究结果公布时,采用生物标志物检测的默沙东给出了高度积极的结果。
随后2017年5月,FDA加速Keytruda批准,适应症扩展到可用于治疗微卫星不稳定性高(Microsatellite Instability-High, MSI-H)或错配修复缺陷(Mismatch Repair Deficiency, dMMR)的实体肿瘤。
这是FDA批准的首个不区分肿瘤组织、位置的抗癌药物,这意味着任何实体瘤只要具有DNA不匹配修复缺陷或微卫星不稳定性高状态,就可以使用。
这也代表着肿瘤治疗,打破了以往按照瘤种来源、癌症组织部位治疗的理念,首次基于基因突变层面来治疗。
Keytruda在中国创下最快审批记录
2018年2月,我国国家药品监督管理局(NMPA)受理了默沙东的申请,2018年7月Keytruda获批,整个审批过程不到六个月,创下中国进口抗肿瘤生物制剂最快获批的记录。
(帕博利珠单抗注射液,来源:NMPA)
2018年7月, Keytruda全球销售首次超过Opdivo,成为排名全球第一PD-1药物。根据Biospace公布的《2021年全球最畅销的抗肿瘤药物TOP10》, Keytruda以171.8亿美元位居榜首,以接近1160亿元人民币的全球销售一骑绝尘,将Opdivo远远甩在身后。
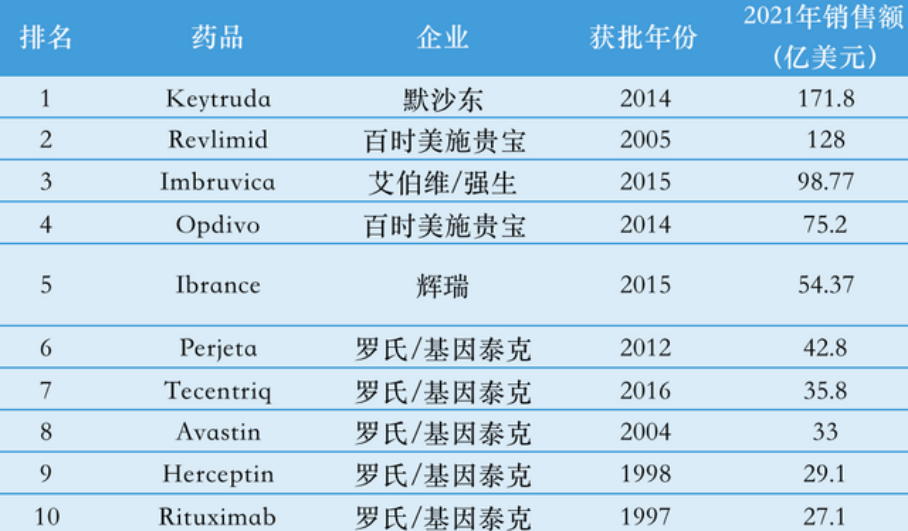
(2021年全球最畅销的抗肿瘤药物TOP10,来源:参考资料6)
在最新发布的一份《2021年全球最畅销药品top20》榜单中,Keytruda的销售额位列全球最畅销药品的第4位,仅次于辉瑞的新冠mRNA疫苗Comirnaty、艾伯维的Humira和Moderna的Spikevax。
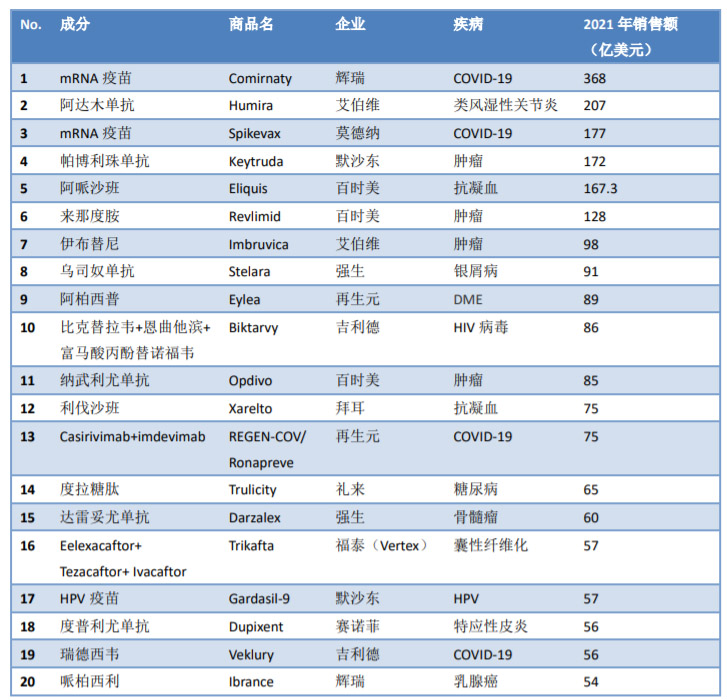
(2021年全球最畅销药品top20,来源:参考资料7)
一份Evaluate Pharma分析预计,Keytruda将在2023年也就是明年取代Humira的“药王”地位,并在2026年实现全球243.2亿美元销售额,登顶世界最畅销的药物榜首。
自此,Keytruda已经先后在美国、欧洲、加拿大、日本、中国等许多国家地区上市。
至2014年首次上市以来,获批肿瘤适应症二十余种,包括黑色素瘤、非小细胞肺癌、小细胞肺癌、头颈癌、经典型霍奇金淋巴瘤、原发纵隔大B细胞淋巴瘤、尿路上皮癌、MSI-H肿瘤、默克尔细胞癌、肾细胞癌等。截止发稿之日,全球仍有几千个相关的临床研究在进行之中。
总结
从阴差阳错的起步,到初见端倪的靶标,当仿佛要见到曙光的时候,又遭遇生不逢时的收购,就在被所有人遗忘的谷底,Keytruda迎来了重启的转机。
新药研发的道路,从来都不是一片坦途,它总是布满荆棘。最后能走到终点的,永远是熬过低谷、敢于尝试,并坚持到底的那个。
Keytruda的未来之路也不会就此一马平川,随着2028年专利到期,虎视眈眈的竞争者赶超,层出不穷的生物类似物上市,面临的挑战只会更加严峻。
它的故事将如何续写?我们拭目以待。
参考文献:
1. 帕博利珠单抗注射剂说明书.默沙东.2018-07-20
2. Keytruda案例.LifeArc官网.
3. MRC Technology, now LifeArc, Set to Invest £500M in UK’s Life Sciences (labiotech.eu). 15/06/2017.
4. The Startling History Behind Merck's New Cancer Blockbuster. David Shaywitz.26/7/2017.
5. Keytruda的故事.药时代.2019年8月5日.
6. 2021抗肿瘤药谁强?罗氏老三驾马车失速,2022年Keytruda或超200亿美元.医药经理人.2022年2月21日.
7.The top 20 drugs by worldwide sales in 2021.Fiercepharma SPECIAL REPORT. May 31, 2022.
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..