日前,国家药监局发布《中华人民共和国药品管理法实施条例》修订草案征求意见稿。其中第二十九条提出,国家鼓励罕见病药品的研制和创新,支持药品上市许可持有人开展罕见病药品研制,鼓励开展已上市药品针对罕见病的新适应症开发,对临床急需的罕见病药品予以优先审评审批。
同时,在药物研制和注册申报期间,加强与申办者沟通交流,促进罕见病用药加快上市,满足罕见病患者临床用药需求。
对批准上市的罕见病新药,在药品上市许可持有人承诺保障药品供应情况下,给予最长不超过7年的市场独占期,期间不再批准相同品种上市。药品上市许可持有人不履行供应保障承诺的,终止市场独占期。
01 罕见病患者用药情况
罕见病是一类发病率低,患病人数少的疾病,目前全球各地对于罕见病并没有统一的定义。美国将患者总人数少于20万的单个疾病定义为罕见病;欧盟将发病率低于1/2000的单个疾病定义为罕见病;日本将患者总数少于5万的单个疾病定义为罕见病;澳大利亚将患者总数少于2000的单个疾病定义为罕见病;罕见病在我国尚无明确的官方定义。
《中国罕见病定义研究报告2021》首次提出将“新生儿发病率小于1/10000、患病率小于1/10000、患病人数小于14万的疾病”列入罕见病。
罕见病用药的研发成本高,市场需求低,药物的研发相对缓慢,部分罕见病存在无药可医的情况。
虽然单个罕见病的患病人数少,但是目前已发现的罕见病病种较多,导致罕见病总人数并不少。
张抒扬的《关爱罕见病,从保障用药开始》提出我国的罕见病患者超2000万。
周盛明等的《中国罕见病用药可负担性评价》通过WHO/HAI标准调差法发现我国34种药品里面16种药品使城镇居民负担较重,19种药品使农村居民负担较重。
致贫作用评价法发现罕见病用药的支出会导致全国超268万居民陷入贫困,灾难性支出评价法发现罕见病用药会导致全国超302万居民发生灾难性支出。目前我国居民罕见病用药可负担性总体较差。
02 每一个小群体都不应该被放弃
全球已知的罕见病超7000种,约占人类总疾病数量的10%。2021年底罕见病大会发布数据,我国有60多种罕见病用药获批上市,但还存在很多罕见病无药可医。为了解决这些问题,目前我国采取了一系列的措施:
一、医保谈判,降低患者用药负担
2018年5月国家卫健委公布《第一批罕见病目录》,第一批罕见病名单涵盖121种罕见病。
自2018年国家医保局成立,国家医保谈判中经常出现罕见病用药——如2021年医保谈判过程中治疗脊髓性肌萎缩病的诺西那生钠注射液,在还没进入医保目录之前,价格高达70万元一针,通过国家谈判进入医保目录后,价格降至3.3万元一针,降价幅度95.3%,且在医保报销后,个人每针花费大约一万元,患者用药负担得到了很大改善。
截至21年12月,国内已有40多种罕见病用药被纳入医保目录。
表:我国药品国家谈判中罕见病用药的数量
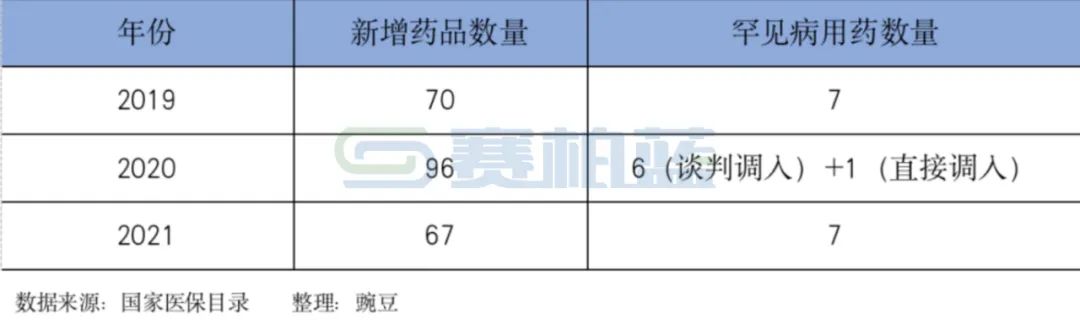
二、优先审评审批,加快罕见病用药上市历程
2020年7月,罕见病的创新药等纳入优先审批程序——对纳入优先审评审批程序的药品上市许可申请,审评时限为130日,其中临床急需的境外已上市境内未上市的罕见病用药审评时限为70日。
通过药智数据发现,截至2022年5月15日,罕见病用药纳入优先审批有115个项目,其中有化药64项,生物制品51项。审批结果见下图
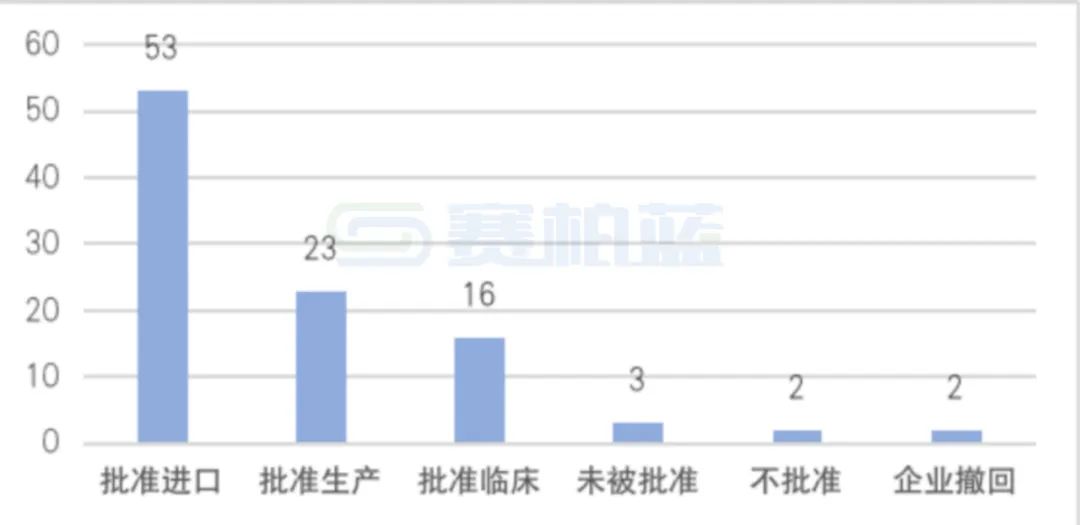
三、最高享有7年独占期,增加企业研发动力
独占期能够保障企业研发药品上市后的市场占有率,可以让企业尽快地收回研发成本并获益,提高企业开发罕见病用药的积极性。市场独占期是欧美国家鼓励罕见病用药研发的手段,美国罕见病用药独占期为7年,欧盟罕见病用药独占期为10年。以下为笔者整理分析的近几年美国罕见病用药(也称孤儿药)的获批情况。
表:美国罕见病用药获批情况
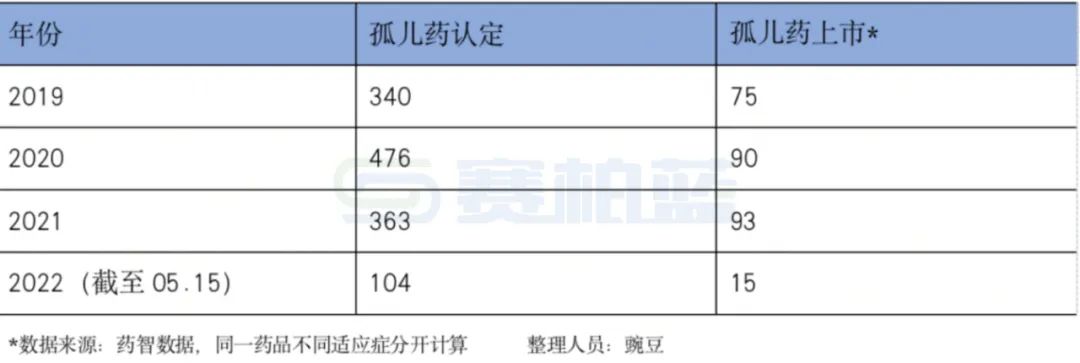
更早之前,2019年2月,《关于罕见病药品增值税政策的通知》发布,通知提出自2019年3月1日起,罕见病用药的销售、批发和零售环节按3%的税率上缴增值税,进口罕见病用药减征3%的进口增值税。
关于召开第七届七次理事会暨会长办公会
各相关单位: 经研究,四川省医..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..认真落实巡视组反馈意见,进一步规范协
按照四川省市场监督管理局党组巡视..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于召开会长办公会的通知
各会长、副会长单位: 根据四川..四川省医药保化品质量管理协会组织召开
2025版《中国药典》将于2025年10月..四川省医药保化品质量管理协会召开第七
四川省医药保化品质量管理协会第七..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..