国家药监局发布医疗器械生产经营分级监管工作的意见,131种医疗器械纳入重点监控,现有医疗器械检查方向、频次、覆盖率等都将发生变化,将影响所有医疗器械生产、经营企业。
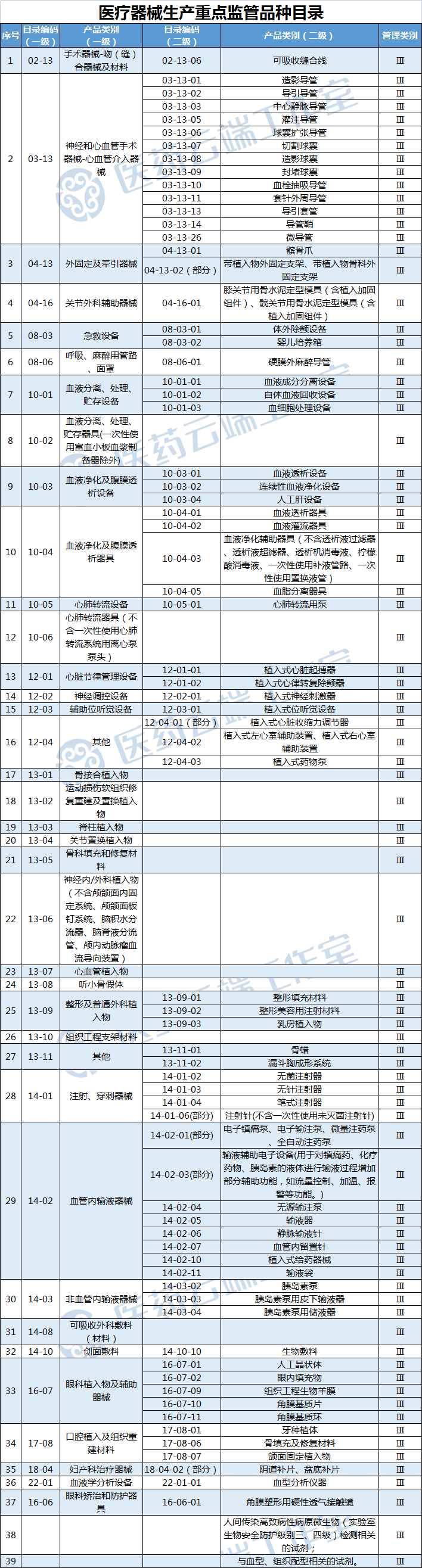
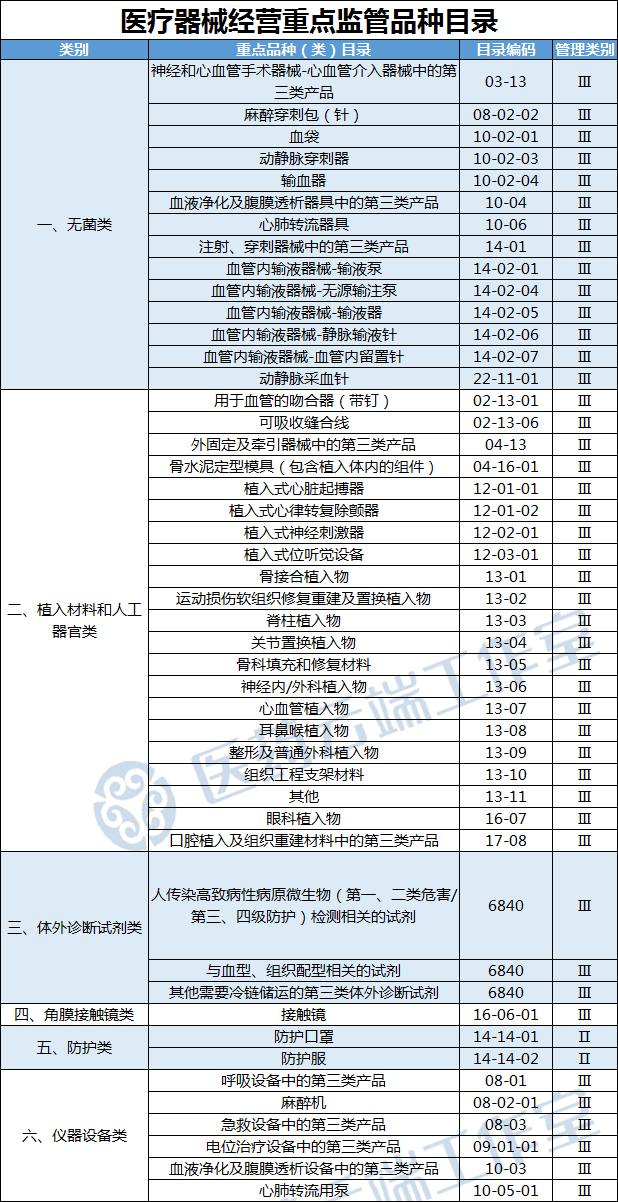
近日,国家药监局就《关于加强医疗器械生产经营分级监管工作的意见(征求意见稿)》公开征求意见,将造影导管、血液透析设备等84种医疗器械纳入生产重点监管品种目录;麻醉穿刺包(针)、血袋等47种医疗器械纳入医疗器械经营重点监管品种目录,并对目录进行动态调整。(具体见文末附表)
《意见稿》要求省、自治区、直辖市药品监督管理部门应当综合分析本行政区域同类产品注册数量、市场占有率、生产质量管理总体水平和风险会商情况等因素,对国家药品监督管理局制定的目录进行补充,确定本行政区域医疗器械生产重点监管品种目录并进行动态调整。
对于跨区域委托生产的医疗器械注册人,由注册人所在地省、自治区、直辖市药品监督管理部门负责研究确定其产品是否纳入本行政区域医疗器械生产重点监管品种目录。
此外,《意见稿》还明确监管级别划分原则,以及对不同监管级别医疗器械经营/生产企业的监督检查形式、频次和覆盖率。
近年来我国医疗器械产业高速发展,监管对象数量快速增加,根据国家药品监督管理局统计年报,我国医疗器械生产企业由2019年底的1.8万家增长至2021年底的2.9万家,经营企业由2019年底的59.3万家增加到2021年底的108.6万家。
同时伴随着社会经济的快速发展,新产品、新技术、新业态的不断涌现。这些医疗器械产业发展中的新情况新问题,都对监管手段、监管方式等提出新的要求,给监管带来新的挑战。
此前,《医疗器械监督管理条例》已于2021年6月1日正式实施,《医疗器械生产监督管理办法》、《医疗器械经营监督管理办法》亦已修订发布并于2022年5月1日施行,医疗器械注册人备案人制度全面实施,医疗器械生产经营活动开展形式更为多样。
不过现行的生产经营分级监管规定分别制定于2014年和2015年,已不完全适应监管新形势新要求:
一是对分级原则和检查频次进行统一规定,但不同省份产业分布和结构差异较大,统一规定不符合部分地区的实际情况,在可操作性方面仍有改进提升的空间;
二是现行生产分级监管规定适用对象为医疗器械生产企业,未考虑仅进行委托生产的注册人备案人的监管等问题,已不完全适应当前注册人备案人制度新形势下监管的需要;
三是经过多年发展,一些产品生产工艺已较为成熟,产品风险得到较好的控制和降低,同时也出现了一批创新产品,重点监管品种目录已不能完全体现产品风险程度;
四是经过多年实践,以“风险管理、全程管控、科学监管、社会共治”为原则的医疗器械监管理念逐步成熟,相较而言,现行规定在对风险的充分识别、科学防控和精准治理等方面存在一定不足。为适应产业发展和监管实践需求,需对现行规定进行修订。
因此为加强医疗器械生产经营监管工作,国家药监局器械监管司组织对现行规定进行修订。此次监管文件的下发,现有医疗器械飞检、常规检查方向、频次、覆盖率等都将发生变化,将影响所有医疗器械生产、经营企业。
与旧版相比,四点重大变化
此次文件的起草总体思路主要把握以下几点:
一是坚持风险管理,根据企业风险程度划分监管级别,实施对应监管措施,实现监管精准化;
二是提升监管效能,合理分配监管资源,坚持问题导向,运用有限的资源有针对性的加强生产经营监督管理,实现监管科学化;
三是适应监管实际,明确地方药品监管部门主导作用,提升分级监管规定可操作性,实现监管实效化。
与老版分级监管规定相比,此次也做了不小的变动。主要修改之处为:
一是将分级监管规定修改为指导意见
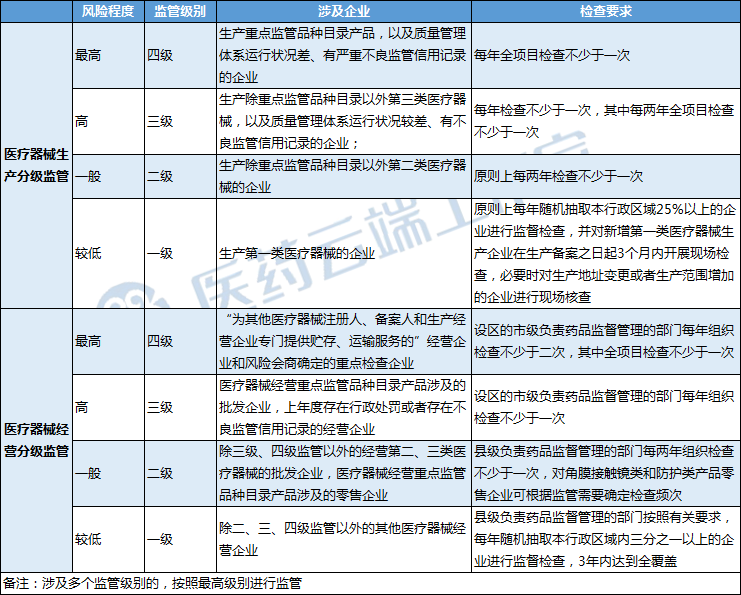
《意见》不再对监管级别划分、检查频次和覆盖率等作出统一规定,而是对地方监管部门进行指导,突出省级药品监督管理部门和设区的市级负责药品监督管理部门主导作用,要求其在摸清产业发展和监管资源配置情况的基础上,制定符合本行政区域监管实际的生产和经营分级监管细化要求,组织实施医疗器械生产经营分级监管工作。
二是精简调整重点监管目录
在医疗器械生产环节,删除对国家级重点监管品种目录产品生产企业实施四级监管、省级重点监管品种目录产品生产企业实施三级监管的规定,明确由省级药品监督管理部门根据实际对国家药品监督管理局制定的目录进行补充,形成本行政区域重点监管目录,并以此为依据划分监管级别;删除吻合器、止血夹等生产工艺较为成熟、风险相对较低的产品,增加近几年新出现的人工肝设备、心脏停跳液等高风险产品。
在医疗器械经营环节,删除免予经营备案的计划生育类产品,将与疫情防控相关的防护服和防护口罩从无菌类产品类别中移出,单独设置防护类产品类别;新增动静脉穿刺器、植入式位听觉设备、硬性接触镜、口腔植入及组织重建材料中的第三类产品等社会关注度高、追溯要求高的产品,删除一次性使用非电驱动式输注泵、电驱动式输注泵等社会关注度小、使用量小的产品。
三是科学强化监督管理
将经营企业监管级别划分和检查要求原则由三级监管增加至四级监管,将“为其他医疗器械注册人、备案人和生产经营企业专门提供贮存、运输服务的”经营企业和风险会商确定的重点检查企业作为风险程度最高的企业实施四级监管,由设区的市级负责药品监督管理的部门每年组织检查不少于二次,其中全项目检查不少于一次;对角膜接触镜类和防护类产品零售企业可根据监管需要确定检查频次;将实施一级监管的企业监管随机抽取比例由30%提升为三分之一。
增加了对于异地增设库房的经营企业、国家集中带量采购中选产品和疫情防控用产品经营企业提出了应当酌情上调监管级别的要求,针对性加强监管。
四是引入信用监管理念
《生产办法》、《经营办法》规定地方药品监管部门应当建立并及时更新辖区内企业信用档案,记录监督检查结果、违法行为查处、质量抽查检验、自查报告、不良行为和投诉举报等信息。
《意见》明确对质量管理体系运行状况差、有严重不良信用记录注册人备案人、受托生产企业实施四级监管,对上年度存在行政处罚或者存在不良信用记录的经营企业实施三级监管;对长期以来质量管理状态和监管信用状况较好的企业,可以酌情下调监管级别。
认真落实巡视组反馈意见,进一步规范协
按照四川省市场监督管理局党组巡视..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于召开会长办公会的通知
各会长、副会长单位: 根据四川..四川省医药保化品质量管理协会组织召开
2025版《中国药典》将于2025年10月..四川省医药保化品质量管理协会召开第七
四川省医药保化品质量管理协会第七..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..学习传达中央八项规定精神专题会议
2025年4月22日,协会党支部组织召..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..