近一个月,百济神州两大首席医学官——免疫肿瘤学首席医学官贲勇、血液肿瘤学首席医学官 黄蔚娟相继离任。
免疫肿瘤学首席医学官由原阿斯利康副总裁、肿瘤学后期开发全球临床负责人Mark C. Lanasa博士接任。
百济神州全球研发负责人汪来博士暂代血液肿瘤学首席医学官。
调整后,据其公告,百济神州目前的核心技术人员仅剩吴晓滨博士和汪来博士。
百济神州对此表示,调整属于公司正常人事变动,不会对公司技术研发、核心竞争力及持续经营能力产生实质性不利影响。市场对此解释似乎不太买账,百济神州三地股市一度下行震荡。
作为中国创新药企全球化的代表,百济神州的高管变动、业务布局与每个阶段业绩相互交织,构成了中国创新药企向前发展的缩影。
2019年:商业化元年
2010年成立的百济神州,在2019年步入商业化。在商业化之前,是创新药企最为核心的研发。
研发:细分领域各设CMO,全球临床开发团队1100多人
区别于其他公司只设一个CMO,2016年,百济神州为其免疫肿瘤和血液肿瘤分别设立了一个CMO。
2016年8月,原Medivation(被辉瑞收购)临床研发总裁Amy Peterson担任其免疫肿瘤首席医学官,负责当时潜力重磅产品BGB-A317(PD-1替雷利珠单抗)、BGB-290(PARP抑制剂 帕米帕利)的后期临床开发。
2016年9月,原Acerta Pharma(被AZ收购)临床开发副总裁黄蔚娟加入百济神州,担任血液肿瘤学首席医学官,负责BTK小分子抑制剂(泽布替尼)的后期临床开发。
黄蔚娟在斯坦福大学获得生物科学学士,在华盛顿大学医学院获得博士学位,并在斯坦福大学完成了内科住院医师培训和血液学及肿瘤学的研究项目。
此后在基因泰克美国任医疗总监,在处于各个不同阶段的几种分子药物开发项目中发挥了主导作用,包括维奈托克和奥比妥珠单抗。
2015-2016年期间,担任血液肿瘤明星公司Acerta Pharma(现为阿斯利康血液肿瘤研发中心)临床开发副总裁,监督BTK抑制剂acalabrutinib的全球临床开发。
2019年2月,Amy Peterson离任,原阿斯利康美国免疫肿瘤全球临床负责人贲勇加入百济神州任免疫肿瘤学首席医学官,主要负责实体瘤项目全球临床研发。
贲勇在吉林大学白求恩医学院获得医学博士学位,在加州大学圣地亚哥分校获得工商管理硕士学位。
毕业后在北京协和医院,担任外科肿瘤学医师;在加州太平洋医学中心完成了博士后研究,此后留在美国工作。
在阿斯利康美国任免疫肿瘤全球临床负责人期间,领导了PD-L1 durvalumab在尿路上皮癌适应症的获批。
截止2019年底,百济神州在研发方面的核心负责人分别为:
中国开发部负责人:汪来
血液肿瘤学首席医学官:黄蔚娟
免疫肿瘤学首席医学官:贲勇
与此同时,百济神州全球临床开发团队1100多人;全球临床项目超过60项;已入组患者及健康受试者超过7500名(40%在海外)。
商业化:收购新基中国商业团队,逐步壮大
百济神州的商业化团队构建于2017年。
2017年7月,百济神州和新基达成合作,百济神州获得新基(被百时美施贵宝收购)ABRAXANE(治疗晚期乳腺癌)、瑞复美(治疗多发性骨髓瘤)、维达莎(治疗骨髓增生异常综合征)三款商业化产品在中国的独家授权。
同时,新基中国商业化团队随之并入百济神州商业化团队。原新基中国商业化负责人严军成为百济神州中国商业运营总经理。以此为基,百济神州商业化团队此后不断扩大。
2018年4月,严军内部转任负责百济神州美国及亚洲地区战略项目。
此后百济神州的中国商业化团队经历变动:
2018年4月,朱益飞任百济神州副总裁,负责中国商业运营、销售、准入及政府事务;
2018年5月,边欣任百济神州大中华区首席商务官;
2019年3月,边欣、朱益飞相继离任。
2019年6月,原赛诺菲特药事业部总经理吴清漪任大中华区首席商务官;原武田制药特药事业部副总裁刘焰任副总裁、大中华区市场营销负责人。
2019年,是百济神州的商业化元年:
11月,首款商业化产品(泽布替尼)在美国获批上市。也成为史上第一个完全由中国企业自主研发得到FDA获批的创新药。
12月,第二款商业化产品(PD-1替雷利珠单抗)在中国获批上市。
从2019年财报来看,自研新产品在年底获批,因此其产品营收仍主要来自百时美施贵宝授权在中国销售瑞复美、维达莎、ABRAXANE。
截止2019年底,百济神州在商业化领域的核心负责人分别为:
大中华区首席商务官:吴清漪
大中华区市场营销负责人:刘焰
同时,百济神州全球商业化团队增长至900多人。
2020年:自研产品开始放量
2020年,是百济神州两款自研产品在全球市场放量的开始。
与此同时,百济神州的研发和商业化高管团队均保持稳定。
研发:全球临床开发团队扩张至1600多人,当年中国企业License in最多的公司
截止2020年底,全球临床开发团队1600多人(+45%);全球临床项目超过60项;已入组患者及健康受试者超过12000名(50%在海外)。
2020年,百济神州研发外部成本与2019年增长41%相比大幅下降,仅增长3.9%。反而预付授权费增长了119%(License in)。
2020年,百济神州有共计五项License in涵盖肿瘤、新冠病毒、乙肝病毒、mRNA疗法、罕见病等;也成为当年中国企业License in最多的公司。
商业化:自研产品营收占比产品总营收66%
在2020年6月,百济神州泽布替尼在中国获批上市。
截止2020年底,
百泽安(PD-1替雷利珠单抗)首年上市销售额1.63亿美元(约合人民币10.55亿元);
百悦泽(泽布替尼)全球销售额4170万美元(约合人民币2.69亿元)。
自研产品营收占比产品总营收66%。
在中国市场,进医保是大多数药品放量的重要途径,尤其是未来DRG/DIP支付落地后,医保更将成为中国医疗体系的重要支持。
2020年,百济神州的三款产品百泽安(自研)、百悦泽(自研)、安加维(引进,合作伙伴为安进)都进入2021国家医保目录。
截至2020上半年,百济神州全球商业化团队超1200人。
2021年:全球营收放量
2021年,百济神州迎来全球放量。是少有的中美营收各占半边天的中国药企。
研发:临床前项目,一半有潜力成为同类首创或同类最佳
2021年底,除了已上市的百悦泽(泽布替尼)、百泽安(PD-1替雷利珠单抗)、百汇泽(PARP 抑制剂帕米帕利)在更多适应症及联合疗法的拓展;百济神州自研临床阶段管线里BGB-11417(BCL2 抑制剂)作为其明星产品,预计将于2022年启动关键性临床试验。
此外在创新质量方面,有超过50个临床前项目,其中约一半有潜力成为同类首创或同类最佳。
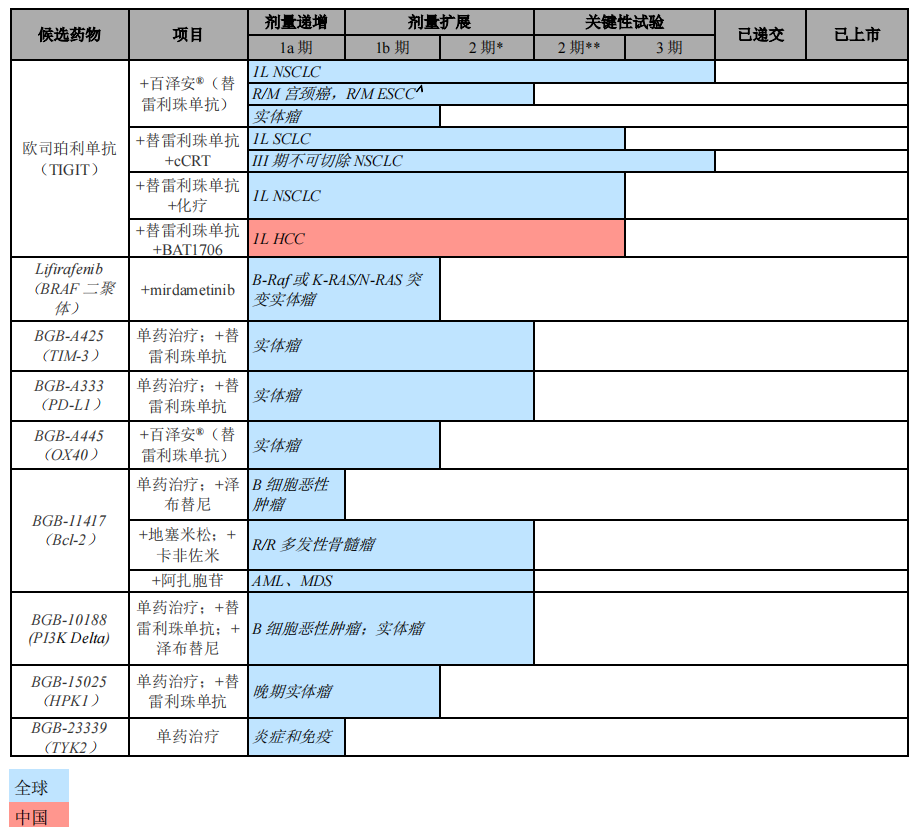
截止2022年2月,百济神州自主研发临床管线
其中进展最快的TIGIT抑制剂欧司珀利单抗(BGB-A1217)目前正在进行两项全球III期临床试验评估。
2021年1月和12月,百济神州分别就百泽安(PD-1替雷利珠单抗)和TIGIT抑制剂欧司珀利单抗与诺华达成全球开发及商业化合作,潜在总交易金额合计将超50亿美元。
截止2021年底,百济神州已在全球建立了一个由2200多名员工(+38%)组成的内部临床开发与医学事务团队,其中肿瘤领域的科学家超过700名。为超过30种药物和候选药物执行90多项正在进行或已计划的临床试验。试验入组超过14500名受试者,其中约半数在中国以外入组。
步入2022年,最近两月,百济神州的两位首席医学官相继离职。
截至目前,百济神州在研发方面的核心负责人分别为:
全球研发负责人:汪来
血液肿瘤学首席医学官:汪来(暂代)
免疫肿瘤学首席医学官:Mark C. Lanasa
Mark C. Lanasa在匹兹堡大学医学院获博士学位;
此后在杜克大学任助理教授;
2014年开始在MedImmune(被阿斯利康收购)负责临床开发;
在阿斯利康超过四年,曾任全球免疫肿瘤临床负责人。
汪来博士自百济神州成立之初加入,2013年主要负责转化医学工作,2016年起,担任中国开发部负责人;2021年4月起,担任全球研发负责人。
从复旦毕业后,汪来在美国拿到博士学位;
年仅24岁便加入美国德州西南医学中心王晓东团队做博士后;
此后加入小分子肿瘤生物科技公司Joyant Pharmaceuticals任研发负责人;
2010年,回国加入百济神州。
商业化:美国市场放量
2021年,百济神州营收11.76亿美元,同比+280.8%。然而在营收高增长的同时,仍面临归母净利润-14.13亿美元;
三款自主研发新药2021年营收4.73亿美元,占比产品总营收74.6%。
亏损较2020年(-15.97亿美元)有所收窄。亏损主要仍然来自于高成本:2021年其销售、研发成本合计超过26.2亿美元。
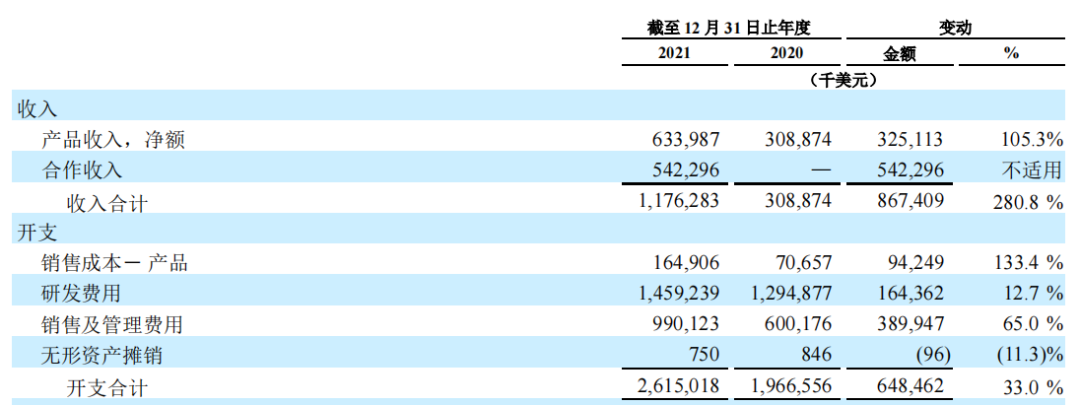
2021年百济神州营收
拥有完整的全球化布局,从研发、生产到商业化价值链,使百济神州在一众中国Bio pharma里走在全球化前列。

2019-2021百济神州产品营收
2021年,百悦泽(泽布替尼)全球销售额约2.18亿美元(+423%),
美国销售额约1.16亿美元(+535%),受此前获批的一个适应症以及2个新适应症(累计FDA获批3个适应症)的批准驱动;
中国销售额约1.01亿美元(+331%),得益于所有获批适应症销售显著增长。
2021年,百泽安(PD-1替雷利珠单抗)销售额(中国)约2.55亿美元(+56.2%),由于医保报销范围扩大带来的新增患者需求、进一步扩大的销售团队和药品进院数量增加所驱动。
在中国市场医保仍是放量的重要途径。
百济神州抗百泽安(PD-1替雷利珠单抗)五项适应症,百悦泽(泽布替尼)三项适应症,百汇泽(PARP 抑制剂帕米帕利),成功纳入2022年开始的国家医保目录。
商业化三年以来,随着2021年美国市场的进一步放量,百济神州已形成中、美市场各分半边天,全球其他市场重要补充的局面。
2019-2021百济神州地区营收
2021年,
中国营收5.17亿美元(+77.9%),占比44%;
美国营收4.95亿美元(+2617%),占比42%;
其他地区营收1.64亿美元,占比14%,主要为合作收入。
生产:中国、美国产能全面布局
目前百济神州在苏州的生产设施超1.3万平方米,包括一个年产能约100百万片剂的小分子药物生产基地及一个500升产能的中试生物制剂生产设施。
在广州建有约10万平方米的生产设施,用于生产大分子生物制剂,未来产能将达20万升。
2021年11月,已完成在美国新泽西州霍普韦尔的普林斯顿西部创新园区的用地收购。用于建设一个占地42英亩(约17万平方米)的世界一流标准生产基地和临床研发中心。工厂预计于2023年竣工,初期将生产生物制剂和小分子抗癌药,包括至多1.6万升生物制剂产能。
截至2022年1月31日,百济神州在全球包括美国、中国、欧洲、澳大利亚等23个国家和地区有大约8200名全职员工,其中美国约1200名员工。
商业化团队超过3100人。
2021年,百济神州的商业化负责人也进行了变更:
大中华区首席商务官:殷敏
10月,原百济神州大中华区首席商务官吴清漪加入迪哲医药任首席商务官;
12月,原阿斯利康肿瘤事业部总经理殷敏加入百济神州,任大中华区首席商务官。
大中华区市场营销负责人:刘焰
此外,11月原阿斯利康中国副总裁、及县业务部负责人杜浩晨加入百济神州,担任广阔市场负责人。因此,2022县域市场或也将成为百济神州的重要布局。
2022年,百泽安(PD-1替雷利珠单抗)或将迎来美国首个获批,百悦泽(泽布替尼)也或将在美国迎来新的适应症。如果以上都能成功获批,百济神州或将在美国市场做更多扩张和布局,而这些成本何时能与营收相平衡,仍是市场对于其的疑问。
“三地上市”是百济神州的标签,受称赞,也受质疑。
2016年3月,百济神州成功登录纳斯达克(截止2022年3月,市值200亿美元)。
2018年8月,百济神州在港股成功上市(截止目前,市值1465亿港元)。
2021年12月,百济神州在科创板成功上市(截止目前,市值1462亿元)。
企业如竹,一家企业持久的增长之道,就是自我革命和内部创新,忘掉成功的过去,不断长出新的“竹节”。
而自从进入商业化阶段后,市场或成为检验企业的重要标准,营收、利润也成为悬于其头上的达摩克利斯之剑。
百济神州会交出怎样的答卷?我们拭目以待。
认真落实巡视组反馈意见,进一步规范协
按照四川省市场监督管理局党组巡视..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于召开会长办公会的通知
各会长、副会长单位: 根据四川..四川省医药保化品质量管理协会组织召开
2025版《中国药典》将于2025年10月..四川省医药保化品质量管理协会召开第七
四川省医药保化品质量管理协会第七..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..学习传达中央八项规定精神专题会议
2025年4月22日,协会党支部组织召..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..