靶向蛋白降解(TPD)是一种新兴的治疗方式,有可能解决传统小分子靶向疗法一直以来面临的极具挑战性的致病蛋白。自报道利用泛素-蛋白酶体系统降解靶蛋白的蛋白水解靶向嵌合体(PROTAC)分子的概念以来的20年中,TPD已从学术界转向制药界,许多公司已经披露了临床前和早期临床项目进展。随着PROTAC分子针对2020年提供的两个公认的癌症靶点的临床概念验证,该领域有望攻克以前被认为是“不可成药”的靶点。
PROTAC靶向蛋白降解剂此前的研究仅仅是该领域的序幕,真正的大戏即将开始!
揭开神秘面纱
通过TPD调节的一类主要分子:蛋白水解靶向嵌合体(PROTAC)蛋白降解剂,是异双功能小分子,由两个通过接头连接的配体组成:一个配体募集并结合感兴趣的蛋白(POI),而另一个配体募集并结合E3泛素连接酶。
PROTAC同时结合POI和连接酶诱导POI泛素化及其随后被泛素-蛋白酶体系统(UPS)降解,之后PROTAC被回收以靶向POI的另一个拷贝(图1)。

图1:PROTAC介导的靶向蛋白降解机制
蛋白水解靶向嵌合体(PROTAC)分子的作用机制示意图:PROTAC分子(在圆圈中放大)是一种异双功能分子,桥接泛素连接酶(蓝色)和靶蛋白(绿色)。首先,PROTAC诱导连接酶和底物接近,泛素(粉红色)将通过连接酶的活性与募集的底物结合。这是一个催化步骤,单个PROTAC分子可以迭代执行,实现泛素化反应的多次转换,从而在底物上形成泛素链。然后泛素链被蛋白酶体(红色)识别,将泛素化的底物穿梭通过其蛋白水解室,并将靶蛋白降解成小肽(绿色)。
正是这种催化类型的作用机制(MoA)和事件驱动的药理学特性将PROTAC与传统抑制剂区分开来,后者与POI具有一对一的关系,其药理学受化学计量学驱动,通常通过与催化位点。
还有几种其他类型的靶向蛋白降解剂。基于沙利度胺及其类似物作为降解分子的偶然发现,分子胶构成了另一个重要的治疗类别。虽然不是PROTAC分子方式的异双功能,但分子胶通过增强连接酶和潜在底物之间的蛋白-蛋白相互作用(PPI)来促进POI的泛素化(图2)。
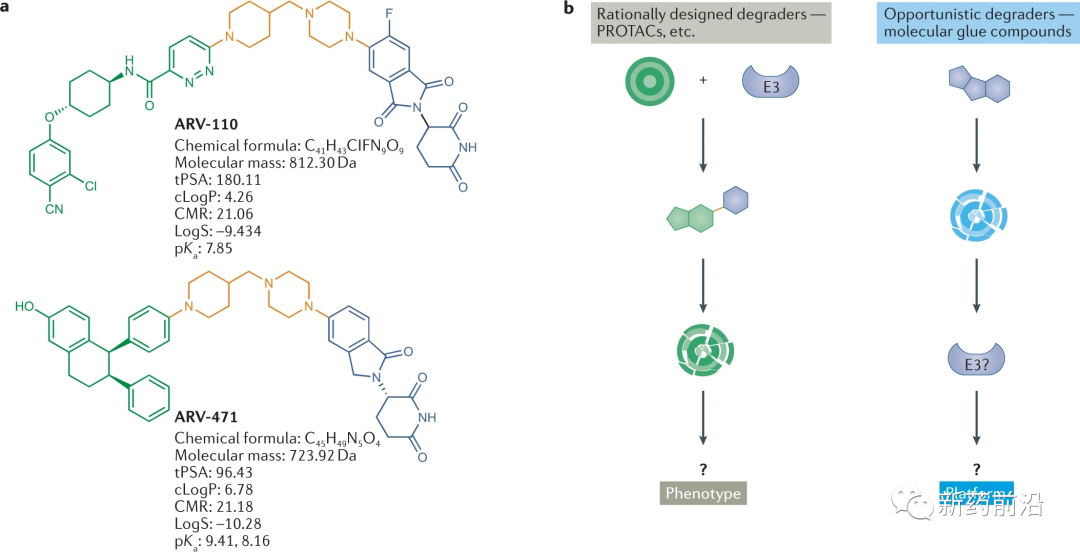
图2:靶向蛋白降解的方式
a已进入临床试验的两种蛋白水解靶向嵌合体(PROTAC)ARV-110和ARV-471的结构和特性。PROTAC由靶点结合部分(绿色)、接头(橙色)和E3连接酶结合部分(蓝色)组成。ARV-110和ARV-471分别靶向雄激素受体和雌激素受体,而E3结合配体与cereblon(CRBN)E3连接酶相互作用。b|靶向蛋白降解的两种基本模式的示意图。左侧:发现由靶结合部分(绿色)、接头(橙色)和连接酶结合部分(蓝色)组成的PROTAC,从而能够合理发现异双功能分子以降解所需靶点。右侧:降解分子的机会性发现,已知分子被证明具有降解作用,从而可以识别介导降解的E3连接酶,并确定该降解机制是否可以扩展以靶向其他感兴趣的蛋白。
自文献报道第一个小分子PROTAC以来的20年中,该技术已从学术界转移到制药界,多家生物技术和制药公司披露了临床前和早期临床开发项目(图3)。

图3:PROTAC发现的时间表
靶向蛋白降解(TPD)的第一个时代始于2001年Sakamoto等人9发表的关键蛋白水解靶向嵌合体(PROTAC)论文,这是首次证明蛋白靶点可以被有意拖到一个泛素连接酶使用化学工具诱导其降解。从那时到今天,该领域呈指数级增长,并已从基于肽的工具降解剂转变为多类全合成小分子,这些小分子可以诱导连接酶和感兴趣的蛋白之间的接近,从而导致其降解。TPD的这个基础时代以2019年进入临床试验的第一个合理的异双功能PROTAC降解剂ARV-110为截止时间,该降解剂通过将雄激素受体(AR)招募到Cullin-RING连接酶4-cereblon(CRL4-CRBN)连接酶来靶向雄激素受体(AR)。当前的TPD时代可以被认为是其最初的转化阶段,其中旨在降解致病蛋白的多种分子正在进入临床,希望为患者提供有意义的益处。DCAF15、DDB1和CUL4相关因子15;IMiD,免疫调节酰亚胺药物;MoA,作用机制;METAP2,甲硫氨酰氨基肽酶2;PoC,概念证明;VHL,冯希佩尔-林道。
2019年,首个PROTAC分子进入临床试验;2020年,这些试验为该模式针对两种公认的癌症靶点提供了第一个临床概念验证:雌激素受体(ER)和雄激素受体(AR)。有了这一成功,TPD领域现在已准备好应对“不可成药”靶点和其他类别的困难蛋白靶点。
未来20年迎突破
除了目前临床测试中的化合物以及多家公司开发管道中的其他化合物之外,TPD领域在未来20年的目标是什么?该领域还存在哪些挑战和可能性,当探索和解决这些挑战和可能性时,还有什么可以完成的?哪些额外的工具——E3连接酶、配体和靶向蛋白降解剂类——可能对哪些疾病有用?
TPD背后的基础科学在过去几年中呈指数级增长并日益成熟。TPD这个“新时代”的下一个里程碑将集中在四个临床转化拐点上:即定义和临床证明降解优于抑制的最佳靶点类别;有针对性地扩大临床使用的E3泛素连接酶的范围,以实现精准医疗;将该模式的临床范围扩展到肿瘤学之外;并在临床环境中验证IMiD和PROTAC之外的TPD模式。
例如,在选择最适合降解的靶点方面。
如上所述,第一波临床阶段蛋白降解剂的靶点是传统药物靶点,这些靶点在疾病和容易获得的化学物质中具有临床验证的作用。针对这些靶点的成功已经开始巩固PROTAC作为一种治疗方式,并强调了这些分子通过降解而不是抑制靶点成为best-in-class药物的潜力。然而,该模式的真正前景是达到目前难以用现有模式药物或根本尚未被药物治疗的靶点。
迄今为止,针对细胞内靶点的传统小分子药物发现研究通常集中在开发高亲和力抑制剂,这些抑制剂靶向酶上的活性位点或变构位点,以关闭POI(占用驱动药理学)的功能。尽管这是一种非常有效的方法,但它使潜在的药物靶点未用药或用药不足。PROTAC将降解功能带到靶点(事件驱动药理学),消除对活性位点的需求,并将不可成药的靶点重新定义为简单的未成药。
PROTAC治疗的最佳靶点,又称之为“PROTAC靶点的原则”(图4),需具有几个共同特征,包括:通过过表达、突变、聚集、同种型表达或定位从自然状态改变,导致疾病的功能获得;E3连接酶可接近的结合表面;理想情况下,一个非结构化区域可以穿入蛋白酶体。对靶向治疗产生抗性突变的蛋白、具有支架功能的蛋白和被认为与其他方式“不可抗药”的蛋白也可以是非常合适的PROTAC靶点。
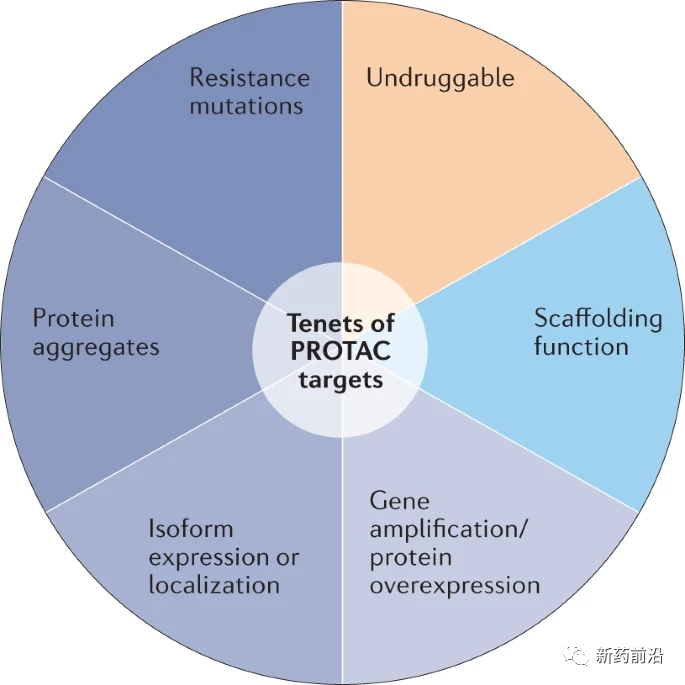
图4:PROTAC靶点的原则
蛋白水解靶向嵌合体(PROTAC)将蛋白降解功能带到靶点;它们不需要在具有生物功能的活性位点内结合。这扩展了可获得的靶点,远远超出了传统化学计量抑制可药物化的靶点,并提供了实现选择性的新方法。可能最适合通过靶向蛋白降解而不是化学计量抑制进行治疗干预的蛋白包括由于突变、过表达、聚集或蛋白同种型的差异表达或定位而具有引起疾病的功能增益的蛋白。从结构的角度来看,PROTAC靶点需要一个E3连接酶可接近的小分子结合表面,并且理想情况下具有可以穿入蛋白酶体的非结构化区域。
总之,随着对基础生物学和化学方面发现和研究的深入,将在未来几十年进一步促进靶向蛋白降解的新突破,我们相信这种模式有可能为患者提供跨越各种适应症的新治疗选择。
参考文献:
Békés, M., Langley, D.R. & Crews, C.M. PROTAC targeted protein degraders: the past is prologue. Nat Rev Drug Discov (2022). https://doi.org/10.1038/s41573-021-00371-6
靶向蛋白降解布局竞争激烈,大药企身影隐现
靶向蛋白降解:作用机制验证首次在随机、安慰剂对照研究中证明
靶向蛋白降解剂:又一颠覆性创新来了
协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于召开第七届七次理事会暨会长办公会
各相关单位: 经研究,四川省医..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..认真落实巡视组反馈意见,进一步规范协
按照四川省市场监督管理局党组巡视..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于召开会长办公会的通知
各会长、副会长单位: 根据四川..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..