来源 | Insight数据库(赛柏蓝授权转载)
作者 | Dopine
2022年,这些新药获批值得期待
2021年截至当前,NMPA已经批准了72款创新药。相较于2019和2020年的50余款,今年国内新药获批再创新高,还带来了多项里程碑式批准:首款CAR-T疗法、首款国产ADC、首款国产PD-L1 单抗……可谓是硕果累累的一年。
2022年同样值得期待。据Insight数据库筛选,以下20款重磅新药在2022年有望获批上市,包括2款三代EGFR-TKIs、2款PI3K抑制剂、2款ALK抑制剂、2款CDK4/6抑制剂、2款ADC产品……
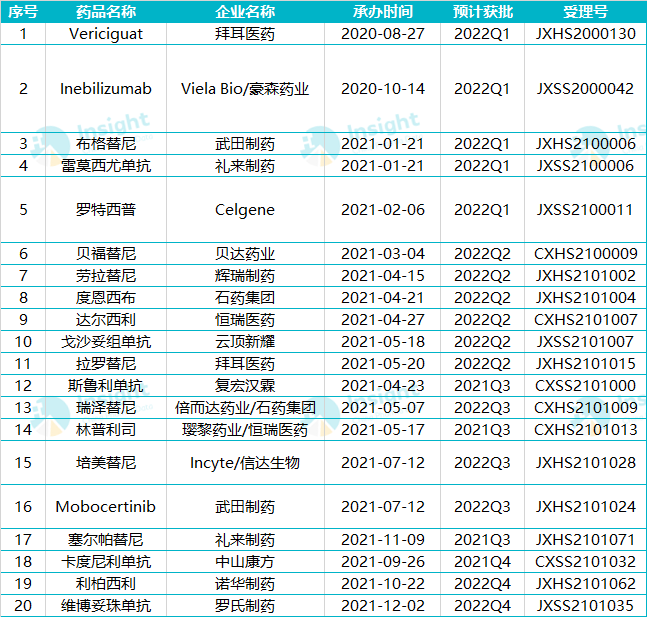
*以上排名不分先后;由于篇幅有限,仅介绍20款有望获批重磅新药,欢迎评论区补充
01 拜耳医药 · Vericiguat 片
Vericiguat是拜耳和默沙东联合开发的一种可溶性鸟苷酸环化(sGC)激动剂,2021年1月在美国被批准用于降低有症状慢性心力衰竭和射血分数低于45%的成年人因心衰住院或需要门诊静脉利尿剂后的心血管死亡和心衰(HF)住院风险,商品名为Verquvo,是首个获批治疗心力衰竭的可溶性sGC刺激剂。
2020年8月,该药在国内报产,随后被CDE以「临床急需的短缺药品、防治重大传染病和罕见病等疾病的创新药和改良型新药」为由纳入优先审评。
02 Viela Bio/豪森药业 · Inebilizumab注射液
Inebilizumab是一种人源化CD19导向性单克隆抗体,通过与CD19抗原结合迅速将这些细胞从血循环中清除,从而降低自身抗体的产生,缓解患者症状。2020年6月,该药被FDA批准用于治疗抗水通道蛋白-4(AQP4)抗体阳性的视神经脊髓炎频谱障碍(NMOSD)成人患者,商品名为 Uplizna。
Inebilizumab由Viela Bio开发,2019年5月翰森制药获得其在中国的开发和商业化授权。2020年10月,该药在国内报产,成为国内首款报产的CD19单抗。在获批上市之后,Inebilizumab也将成为翰森制药首款获批上市的生物药。
03 武田制药 · Brigatinib片
Brigatinib(布格替尼)是武田开发的第二代ALK抑制剂,可有针对性地靶向和抑制ALK融合蛋白,已先后被FDA批准用于治疗接受crizo-tinib治疗之后疾病继续进展的ALK阳性转移性NSCLC(2017/04),以及单药一线治疗携带ALK阳性晚期NSCLC(2020/05),商品名为 Alunbrig。
在国内,Brigatinib于2021年1月在国内报产,预计明年第一季度在国内获批。
04 礼来制药 · Ramucirumab注射液
Ramucirumab(雷莫西尤单抗,曾用名:雷莫芦单抗)是一款人血管内皮生长因子受体2(VEGFR2)拮抗剂,通过特异性地与VEGFR2结合阻断VEGFR2与VEGF-A、C、D的结合,从而抑制血管增生,使肿瘤无法进一步生长或蔓延。目前,该药已被FDA批准用于治疗晚期/转移性胃癌、NSCLC、晚期/转移性结直肠癌、肝细胞癌和EGFR突变晚期/转移性NSCLC 5项适应症,商品名为Cyramza。据礼来财报,Cyramza已进入重磅产品行列,2020年全球销售额高达10.33 亿美元。
在国内,Ramucirumab于今年1月在国内报产,预计将于明年第一季度在国内获批。而且,该药还于今年8月在国内递交了新适应症上市申请,相关受理号为 JXSS2101017/18。
05 Celgene · 注射用罗特西普
罗特西普(luspatercept)是Celgene与Acceleron制药公司合作开发的一种首创红细胞成熟剂,它是一种可溶性融合蛋白,由人IgG1的Fc结构域与激活素IIB型受体(ActRIIB)胞外结构域融合而成,作为一种配体陷阱,通过靶向结合可调节晚期RBC成熟的转化生长因子(TGF)-β超家族的特定配体,减少Smad2/3信号通路的激活,改善无效红细胞的生成,促进晚期红细胞的成熟,提高血红蛋白水平。
2019年11月,该药被FDA批准用于需要定期输注红细胞的β地中海贫血成人患者,商品名为Reblozyl。2020年4月,该药又被FDA批准用于治疗成人低危骨髓增生异常综合症(MDS)相关贫血。
在国内,罗特西普于今年2月在国内报产,随后被CDE以「符合附条件批准的药品」为由纳入优先审评,拟定适应症为:需要定期输注红细胞(RBC)的成人β-地中海贫血患者。
06 贝达药业 · 甲磺酸贝福替尼胶囊
甲磺酸贝福替尼是贝达药业开发的一款针对T790M突变的第三代 EGFR-TKI,今年3月在国内递交治疗既往使用EGFR-TKI耐药后产生 T790M 突变的局部晚期或转移性非小细胞肺癌治疗的上市申请。
该药治疗一代EGFR-TKI耐药后产生T790M突变的局部晚期或转移性非小细胞肺癌患者的2期研究结果显示:经独立评审委员会(IRC)评估的客观缓解率(ORR)为64.8%,疾病控制率(DCR)为95.2%。34例基线有颅内靶病灶的脑转移受试者颅内客观缓解率(iORR)为52.9%,颅内疾病控制率(iDCR)为97.1%。
目前,国内已经批准三款针对T790M突变的第三代EGFR-TKIs,即奥希替尼、阿美替尼和伏美替尼。此外,贝福替尼(贝达药业)、瑞泽替尼(倍而达药业)和ASK120067(奥赛康药业)三款第三代EGFR-TKIs 已经先后在国内报产。根据报产时间,贝福替尼有望在Q2获批,成为第三款国产三代 EGFR-TKI。
07 辉瑞制药 · Lorlatinib片
Lorlatinib(劳拉替尼)是一款第三代ALK抑制剂,可针对不同类型的 ALK突变,同时具有较强的血脑屏障透过能力,特别适合对其他ALK耐药的晚期NSCLC。目前,该药已在美国获批2项适应症:既往接受过克唑替尼和至少一种其他ALK抑制剂的治的ALK阳性转移性NSCLC(2018/11);一线治疗ALK阳性NSCLC(2021/03)。
在国内,Lorlatinib于今年4月在国内报产。此外,该药还于7月在国内递交第二个上市申请,相关受理号为JXHS2101031/32,随后该申请被纳入优先申请,拟定适应症为既往接受过一种或多种ALK酪氨酸激酶抑制剂治疗的ALK阳性局部晚期或转移性非小细胞肺癌患者。
值得一提的,目前国内NMPA已经批准4款ALK抑制剂,即克唑替尼(辉瑞,2013/01)、塞瑞替尼(诺华,2018/05)和阿来替尼(罗氏,2018/08)和恩沙替尼(贝达药业,2020/10)。此外,Brigat-inib(武田)、Lorlatinib(辉瑞)和依鲁奥克(齐鲁制药)三款ALK 抑制剂也先后在国内报产。
08 石药集团 · 度恩西布胶囊
度恩西布(duvelisib,Copiktra)是一种PI3K抑制剂,可作用于PI3K-δ 和PI3K-γ两个靶点,2018年9月被FDA批准用于治疗已经接受过至少两次前期疗法的复发/难治性慢性淋巴性白血病(CLL)和小淋巴细胞淋巴瘤(SLL)成年患者。同时,该药还被FDA加速批准用于治疗至少接受过两次前期疗法的复发/难治性滤泡性淋巴瘤(FL)成年患者。
2018年9月,石药集团从Verastem Oncology公司获得度恩西布在中国 (包括香港、澳门及台湾) 的开发及商业化授权。今年4月,度恩西布在国内报产,随后被CDE纳入优先审评,拟定适应症为既往至少经过两次系统治疗的复发或难治性滤泡性淋巴瘤。
值得一提的是,目前国内已有3款PI3K抑制剂报产,即拜耳的Copanlisib注射用冻干制剂、石药集团的度恩西布胶囊和璎黎药业的林普利司片。
09 恒瑞医药 · SHR6390 片
SHR6390是恒瑞医药研发的一种口服、高效、选择性的小分子CDK4/6 抑制剂。2020年12月,恒瑞医药宣布SHR6390联合氟维司群治疗HR 阳性、HER2阴性的经内分泌治疗后疾病进展的局部晚期或晚期乳腺癌的 3期临床研究达到主要研究终点:对于既往接受过内分泌治疗的激素受体(HR)阳性,人表皮生长因子受体2(HER2)阴性晚期乳腺癌患者,接受SHR6390联合氟维司群对比安慰剂联合氟维司群,可显著延长患者的无进展生存期。
今年4月,SHR6390在国内递交联合氟维司群治疗HR阳性,HER2阴性的经内分泌治疗后进展的复发或转移性乳腺癌的上市申请,随后该申请被 CDE纳入优先审评。
值得一提的是,国内已经批准2款CDK4/6抑制剂,即辉瑞哌柏西利(商品名:爱博新)、礼来的阿贝西利(商品名:唯择)。此外,SHR6390、利柏西利(诺华)和曲拉西利(先声药业/G1 Therapeutics)三款CDK4/6抑制剂也已先后在国内报产,预计SHR6390有望成为国内获批的首款原创CDK4/6 抑制剂。
10 云顶新耀 · 注射用戈沙妥组单抗
戈沙妥组单抗(sacituzumab govitecan-hziy,Trodelvy)是一款靶向Trop-2的新型、首创抗体偶联药物(ADC),由靶向TROP-2抗原的人源化 IgG1抗体与化疗药物伊立替康(一种拓扑异构酶 I 抑制剂)的代谢活性产物SN-38偶联而成,药物-抗体比(DAR)高达7.6:1。2020 年4月,该药被FDA加速批准用于治疗先前已接受过至少2种疗法、其中至少1种疗法治疗转移性疾病的不可切除性局部晚期或转移性三阴性乳腺癌(mTNBC)成人患者,2021 年4月获得完全批准。
戈沙妥组单抗由Immunomedics 公司开发,2019年4月云顶新耀以 8.35亿美元从 Immunomedics 公司获得该药在大中华区、韩国、部分东南亚国家用于所有癌症适应症的独家权利。今年5月,该药在国内报产,随后该上市申请被CDE纳入优先审评,拟定适应症为接受过至少2线既往治疗的转移性三阴性乳腺癌成人患者。
11 拜耳医药 · 硫酸 Larotrectinib胶囊
Larotrectinib(拉罗替尼)由拜耳和Loxo联合开发的一种高选择性肌球蛋白受体激酶(TRK)抑制剂,是FDA批准的首个「不区分肿瘤类型的治疗药物」,2018年11月被FDA批准用于治疗携带NTRK基因融合的成年和儿童局部晚期或转移性实体瘤患者,不需考虑癌症的发生区域,商品名为Vitrakvi。
2021年5月,该药在国内报产,且被CDE以「符合附条件批准的药品」为由纳入优先审评。
12 复宏汉霖 · 斯鲁利单抗注射液
斯鲁利单抗是复宏汉霖自主研发的一款PD-1单抗,今年4月其针对高度微卫星不稳定型(MSI-H)实体瘤适应症申请获CDE受理,且被纳入优先审评。值得一提的是,斯鲁利单抗是国内首个针对高度微卫星不稳定型(MSI-H)实体瘤适应症提交上市申请的PD-1单抗。此外,斯鲁利单抗联合化疗一线治疗局部晚期或转移性鳞状非小细胞肺癌(sqNSCLC)的上市申请已于今年9月获CDE受理。
目前,国内PD-1单抗市场竞争激烈,目前已有8款产品获批上市,其中2款进口,6款国产。
13 倍而达药业/石药集团 · 甲磺酸瑞泽替尼胶囊
甲磺酸瑞泽替尼(BPI-7711)是一款不可逆、高选择性的第三代小分子 EGFR-TKI,对EGFR敏感突变及EGFR T790M耐药突变具有显著的抑制活性。研究表明,BPI-7711在体外细胞实验中对EGFR(T790M/L858R、外显子19缺失) 基因突变的非小细胞肺癌表现出明显的抗肿瘤活性,且有效抑制浓度(EC50)比EGFR基因野生型的抑制浓度低35倍以上,体现了较好的安全性。
2021年3月,石药集团与倍而达药业订立产品授权及商业化协议,获得 BPI-7711在中华人民共和国(包括香港特别行政区和澳门特别行政区,但不包括台湾地区)的商业化授权。2021年5月,倍而达药业向NMPA 递交了新药上市申请。
14 璎黎药业 · 林普利司片
林普利司(YY-20394)是璎黎药业研发的新一代磷酯酰肌醇3-激酶亚型δ(PI3Kδ)高选择性抑制剂。今年2月,恒瑞医药与璎黎药业签订战略合作协议,获得该药在大中华地区的联合开发权益以及排他性独家商业化权益。
今年5月,林普利司治疗复发/难治滤泡性淋巴瘤的适应症申请获CDE受理,且被纳入优先审评程序。据悉,该药在89例(可评估病例)复发/难治滤泡性淋巴瘤患者中的客观缓解率(ORR)达80% 以上,疾病控制率(DCR)达95%以上。而且该药口服给药安全可控、耐受性好。恶心、腹泻、肝毒性等不良反应发生率低于同靶点药物文献报道。
15 Incyte/信达生物 · Pemigatinib片
Pemigatinib(商品名:Pemazyre)是Incyte公司研发的一款针对成纤维细胞生长因子受体(FGFR)亚型1、2、3的强效选择性口服抑制剂,2020年4月被FDA批准用于治疗先前已接受过治疗、存在FGFR2融合或重排、不能手术切除的局部晚期或转移性胆管癌(CCA)患者,是 FDA 批准的首个胆管癌靶向治疗药物。
2018年12月,信达生物与Incyte公司达成战略合作和独家授权许可协议,获得pemigatinib和另外两款药物itacitinib(JAK1抑制剂)和 parsaclisib(PI3Kδ抑制剂)单药或联合治疗在中国内地及香港、澳门和台湾地区的临床开发与商业化授权。
2021年7月,该药在国内报产,随后被CDE纳入优先审评,拟定适应症为:既往至少接受过一种系统性治疗,且经检测确认存在有 FGFR2 融合或重排的晚期、转移性或不可手术切除的胆管癌成人患者。
16 武田制药 · Mobocertinib 胶囊
Mobocertinib是武田研发的一种新型、高选择性靶向于EGFR和人表皮生长因子受体2(HER2)20号外显子插入突变的小分子酪氨酸激酶抑制剂 (TKI),今年9月被FDA加速批准用于治疗携带EGFR 20号外显子插入突变并且接受铂类药物化疗后疾病进展的局部晚期或转移性NSCLC成人患者,商品名为Exkivity,成为 FDA批准的首个针对EGFR Exon20插入突变的口服疗法。
此外,值得一提的是,强生的EGFR-MET双特异性抗体Rybrevant(amivantamab-vmjw)于今年5月被FDA批准用于治疗在接受含铂化疗失败后病情进展、EGFR基因外显子20插入突变阳性(EGFRex20ins+)的转移性非小细胞肺癌(mNSCLC)成人患者。
今年7月,Mobocertinib在国内报产,随后被纳入优先审评,拟定适应症为:既往接受过化疗且携带表皮生长因子受体(EGFR)20号外显子插入突变的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者。
17 礼来制药 · Selpercatinib 胶囊
Selpercatinib是礼来研发的一种强效、口服、高度选择性转染期间重排 ( RET) 激酶抑制剂,同时也是首个靶向RET激酶的抑制剂,通过抑制异常RET激酶的活性而发挥作用,2020年5月被FDA批准用于治疗转移性RET融合阳性的 NSCLC,需要系统治疗的晚期或转移性、RET融合阳性的甲状腺癌,以及需要系统治疗的RET突变型甲状腺髓样癌 (MTC) ,商品名为Retevmo。
今年11月,Selpercatinib在国内报产,随后被CDE纳入优先审评,预计明年第三季度有望获批。
18 中山康方 · 卡度尼利单抗注射液
卡度尼利单抗(Candonilimab,研发代号:AK104,曾用名:凯得宁单抗)是康方生物自主研发的新型的、首创PD-1/CTLA-4双特异性肿瘤免疫治疗骨干药物,主要适应症包括肺癌、肝癌、胃癌、宫颈癌、肾癌、食管鳞癌及鼻咽癌等多种恶性肿瘤,相关肿瘤的研究阶段性数据显示,凯得宁单抗与PD-1联合CTLA-4的联合疗法相比,毒性显著降低,具有明显的安全性和疗效优势。
2020年10月,凯得宁单抗用于经标准治疗后的复发或转移性宫颈鳞癌获得CDE审核批准纳入「突破性治疗品种」名单。
今年9月,凯得宁单抗用于治疗复发或转移性宫颈癌的上市申请获CDE受理,并获优先审评,成为全球第一个递交上市申请的基于PD-1的双特异性抗体药物,也成为中国自主研发的首款双特异性抗体药物。
19 诺华制药 · 琥珀酸利柏西利片
利柏西利(ribociclib,Kisqali)是全球第2款获批上市的CDK4/6抑制剂,目前已在美国获批多个适应症,包括:1)与芳香化酶抑制剂联合,用于绝经前/围绝经期以及绝经后激素受体 (HR) 阳性、人表皮生长因子受体2(HER2) 阴性晚期或转移性女性乳腺癌患者。2)与氟维司群联用作为初始内分泌治疗或用于初始内分泌治疗失败疾病进展的HR+,HER2-晚期或转移性女性乳腺癌患者。据诺华财报,2020年其全球销售额高达6.87亿美元。
在国内,利柏西利于今年10月在国内报产,预计明年第四季度有望获批。
20 罗氏制药 · 注射用维博妥珠单抗(拟定)
维博妥珠单抗是罗氏旗下基因泰克利用西雅图遗传学公司的ADC技术开发的一款B细胞抗原受体复合物相关蛋白β链(CD79b)靶向抗体偶联药物(ADC),由人源化抗CD79b抗体与小分子微管抑制剂MMAE(单甲基阿司他丁 E)偶联而成。2019 年6 月,该药被FDA批准联合苯达莫司汀和利妥昔单抗用于复发或难治性弥漫性大B细胞淋巴瘤,商品名为Polivy,成为全球首款用于弥漫性大B细胞淋巴瘤的ADC疗法。
此外,近日罗氏宣布Polivy与R-CHP方案(即利妥昔单抗+环磷酰胺+多柔比星+泼尼松方案)联用一线治疗DLBCL的3期临床试验取得积极结果:与目前标准治疗方案R-CHOP(即利妥昔单抗+环磷酰胺+多柔比星+长春新碱+泼尼松)相比,Polivy联合R-CHP可将患者疾病进展或死亡风险降低27%。这是20多年来与标准治疗相比,首个显著改善此类患者结局的治疗方案。
在国内,维博妥珠单抗于今年12月在国内报产,预计明年第四季度有望获批。
认真落实巡视组反馈意见,进一步规范协
按照四川省市场监督管理局党组巡视..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于召开会长办公会的通知
各会长、副会长单位: 根据四川..四川省医药保化品质量管理协会组织召开
2025版《中国药典》将于2025年10月..四川省医药保化品质量管理协会召开第七
四川省医药保化品质量管理协会第七..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..学习传达中央八项规定精神专题会议
2025年4月22日,协会党支部组织召..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..