“双十一”,万众瞩目的2021年国家医保谈判谢幕,再次引发全社会对于创新药的高度关注。近几年,新医改大背景下的中国创新药产业如火如荼,那么产业发展情况究竟如何?对此,伴随而起的各家商用医药数据库纷纷给出自己的答案。然而,美中不足的是,创新药领域相对缺乏官宣的权威数据。
有鉴于此,国家药监局药审中心在11月10日发布了《中国新药注册临床试验现状年度报告(2020年)》(下称“报告”),基于自有的药物临床试验登记与信息公示平台(chinadrugtrials.org.cn),首次对中国新药注册临床试验现状进行全面汇总分析。
临床试验总体数量
虽然报告标题为“中国新药注册临床试验”,但CDE的药物临床试验平台包含了各类型药物的临床试验,报告相应地统计分析了相关数据。2020年共登记临床试验2602项,相比2019年总体增长9.1%。按创新属性区分,新药(创新药+改良型新药)的临床试验登记1473项,超过了仿制药的1129项。这是否说明新药数量多于仿制药了呢?
一方面,通常新药针对单个适应症需进行I~III期临床试验,如有多个适应症,那么需进行的试验数量更多;而仿制药通常只进行一个生物等效性试验(BE)用于一致性评价,仅有少数需要进行验证性试验。另一方面,国家药品集采已经执行了五批,常用的主要仿制药品种已经纳入,所剩不多。因此,仅从登记试验数量,不能断定新药的数量多于仿制药。然而,这反映了中国新药研发颇具活力,创新转型已经成为企业共识。
新药临床试验申办者、药物类型
根据临床试验申请受理号区分,基于进口临床申请的试验由国外企业(sponsor)申办,其他为国内企业申办。新药临床试验有1142项由国内企业申办,331项由国外企业申办,接近4:1。其中,国外企业申办的新药临床试验中包括208项国际多中心试验(MRCT),123项国内试验。
按药物类型区分,在2020年登记的全部2602项临床试验中化学药、生物制品、中药的占比分别为73.6%、23.8%和2.6%。化学药占比最高一方面是中国制药业仍基于传统的化学合成,另一方面是仿制药除了少量中药仿制药,绝大部分为化药仿制药。在2020年登记的1473项新药临床试验中,化学药、生物制品、中药分别登记了801项、605项和67项。这反映了新药领域中,生物创新药发展迅猛,PD-(L)1的激烈竞争即为一个缩影。
图表1. 2020年登记的新药临床试验的药物类型划分
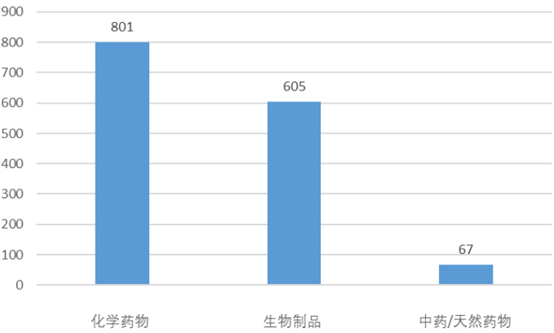
来源:CDE,中康产业资本研究中心
临床试验top10品种、靶点
在化学药临床试验(扣除生物等效性试验)中,登记试验数量前10的品种基本为抗肿瘤药物,其中恒瑞医药的甲磺酸阿帕替尼片以15项居首,主要为与其他药物联用的临床试验。在Top10化药新药中,恒瑞医药独占7个:阿帕替尼、氟唑帕利、吡咯替尼、法米替尼、SHR6309、SHR3680、SHR1459。这体现了“创新药一哥”的强大实力,也从侧面反映了恒瑞医药在2020年进一步加快研发进度。
图表2. 非BE临床试验数量top10化学药

来源:CDE,中康产业资本研究中心
在生物制品中,登记临床试验数量前10位的品种包括8个治疗用生物制品和2个预防用生物制品(疫苗)。以“重组人源化抗PD-1单克隆抗体注射液”为药物名称登记的临床试验多达17项,申办者包括君实生物(5项)、康方生物(5项)、新时代药业(4项)、神州细胞(1项)和丽珠单抗(1项)。此外,阿斯利康的T药(阿替利珠单抗)、默沙东的K药(帕博利珠单抗)、恒瑞医药的卡瑞利珠单抗、阿斯利康的I药(Durvalumab)分别登记了11项、11项、7项和6项临床试验。预防用生物制品中,新冠灭活疫苗(Vero细胞)和四价流感病毒裂解疫苗分别登记了10项和8项临床试验。
图表3. 登记临床试验数量top10的生物制品

来源:CDE,中康产业资本研究中心
登记试验数量top10的靶点依次为PD-1、CYP51A1、VEGFR、PD-L1、DNA、微管、EGFR、HER2、PARP、GLP-1R,其中前三个靶点登记的试验数量均超过了60项。除了GLP-1R与糖尿病治疗相关,其他9个靶点集中在肿瘤治疗领域。II期临床试验在各靶点中的占比均较低,试验阶段在各靶点呈现两极分化,这在某种程度上反映国内新药研发在进度上已经出现了梯队分化。靶点扎堆情况仍未明显缓解,表明国内新药研发仍然以仿创和快速跟进为主。在CDE发布《以临床价值为导向的抗肿瘤药物临床研发指导原则》征求意见稿发布之后,一些研发进度较落后的项目将面临着取舍。
图表4. 登记临床试验数量top10靶点及试验分期
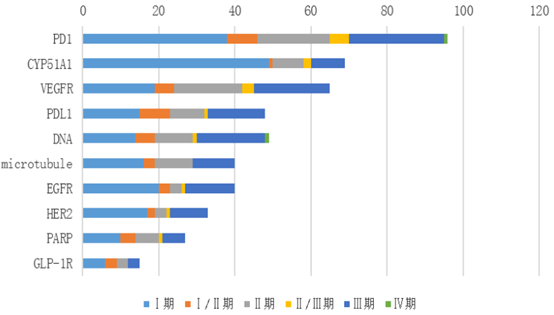
来源:CDE,中康产业资本研究中心
临床试验执行情况
临床试验申请获批后6个月内启动受试者招募的占比为24.9%,1年内启动招募的占比为45.4%。值得注意的是,直至临床试验批件3年有效期到期仍未启动招募的占比为19.8%,不论对于药监机构还是企业,这都是较大的资源浪费。
在1473项新药临床试验中,2020年完成121项,其中I期~IV期试验数量分别为93项、10项、5项和2项,其他试验为11项。根据登记的国内试验完成日期和国内首例知情同意(ICF)日期,临床试验完成时间范围为6~735个自然日,其中I期试验平均耗时95.7天,III期试验平均耗时176.6天,II/III期序贯试验平均耗时386天。
图表5. 2020年登记完成的临床试验平均耗时
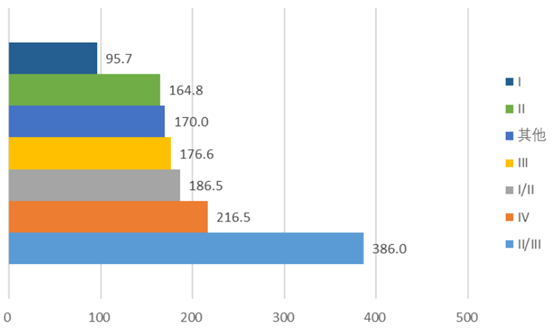
来源:CDE,中康产业资本研究中心
特殊人群中的临床试验
在1473项新药临床试验中,有1038项试验包括老年人受试者,仅在老年人群中开展的试验有3项。这可能因为新药研发较集中的治疗领域,如肿瘤、自身免疫性疾病、内分泌系统疾病的发病与年龄增长相关,均包含了大量老年患者。
在儿童中开展临床试验不仅患者招募困难,同时也要更加谨慎。在新药临床试验中,含儿童受试者的试验有129项(8.8%),只在儿童中开展的试验仅33项(2.2%)。按适应症划分,生物制品和化学药主要为抗肿瘤药、预防性疫苗、皮肤和五官科药物、抗感染药物,中药/天然药物为呼吸类药物和皮肤科药物。
结 语
官宣临床试验年报是药监局的又一次大胆尝试,在探索运用信息化手段提升药品监管的道路继续迈进。官方数据具有权威性、准确性,能够对市场上的商用数据起到正本清源的作用。及时发布临床试验信息,能够为新药研发、资源配置、药品审评起到积极的引导作用。希望未来药监局能够坚持,持续记录中国创新药产业进展。
关于召开第七届七次理事会暨会长办公会
各相关单位: 经研究,四川省医..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..认真落实巡视组反馈意见,进一步规范协
按照四川省市场监督管理局党组巡视..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于召开会长办公会的通知
各会长、副会长单位: 根据四川..四川省医药保化品质量管理协会组织召开
2025版《中国药典》将于2025年10月..四川省医药保化品质量管理协会召开第七
四川省医药保化品质量管理协会第七..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..