▎药明康德内容团队编辑
据不完全统计,创鉴汇监测到2021年10月中国生物医药领域的抗肿瘤公司共披露融资事件30起。据悉,融资金额将用于各家公司推进产品管线的研发,加速临床前及临床阶段的研究。本文将为您提供10月融资事件汇总,同时精选7家融资金额达亿元的公司进行盘点。
1.维立志博完成近1亿美元C轮融资,加速双特异性抗体新药临床研究
日期:2021-10-08
轮次:C轮
金额:近1亿美元
投资机构:正心谷创新资本(Loyal Valley Capital)领投
标签:免疫疗法、靶向疗法、单克隆抗体、双特异性抗体、融合蛋白
10月8日,南京维立志博生物科技有限公司(以下简称“维立志博”)宣布完成近1亿美元C轮融资,本轮融资由正心谷资本领投,龙磐投资、德屹资本、深创投、安捷证券、荣昌创投、贞吉资本跟投,老股东恩然创投、汉康资本、厚新健投、怀格资本、庄钟创投、新丝路投资追加投资。据新闻稿显示,本轮融资资金将主要用于加速推进现已进入临床阶段抗体新药项目的临床试验,推动其他项目的早期研发及临床前研究等。
维立志博成立于2012年,是一家临床阶段的生物医药公司。该公司专注创新型抗体药和融合蛋白药物研发,聚焦新型癌症免疫治疗新药研发及产业化,已经拥有十余个在研管线,包括免疫治疗、靶向治疗和双特异性抗体。据官网资料介绍,维立志博已搭建了抗体发现平台及双多特异性抗体平台,并开发了“ACE”抗体平台,以获得抗体依赖性细胞毒性(ADCC)和补体依赖性细胞毒性(CDC)效应显著的抗体分子。新闻稿显示,该公司的LBL-007(LAG-3单抗)、LBL-003(TIM-3单抗)、LBL-015(PD-1/TGFβ双抗)、LBL-024(PD-L1/4-1BB双抗)均已获得美国FDA、中国NMPA临床试验许可,即将开展临床研究。

▲维立志博的在研管线(图片来源:维立志博官网)
LBL-015是一款靶向程序性死亡蛋白1(PD-1)和转化生长因子-β(TGF-β)的四价双特异性融合蛋白,由高亲和力的抗PD-1的单克隆抗体和TGFβRⅡ蛋白两部分融合而成。该在研新药能够同时阻断PD-1/PD-L1和TGFβ免疫抑制通路,具有克服肿瘤细胞对抗PD-1治疗耐药性的潜力。体外研究显示,在PD-1和TGF-β1诱导的肿瘤免疫逃逸和异常微环境中,LBL-015均具有很好的协同抗肿瘤作用。
LBL-024是一款可同时靶向程序性死亡配体-1(PD-L1)和4-1BB(CD137/TNFRSF9)的四价双特异抗体,由亲和力高度差异化的抗PD-L1的单抗和4-1BB单抗组成,以期在肿瘤微环境中阻断PD-1/PD-L1免疫抑制通路并激活4-1BB通路。临床前研究显示:LBL-024在小鼠肿瘤模型中显示出了强大的协同抗肿瘤效果,比单独靶向PD-L1或4-1BB的抗体更有效;由于两个分子之间具有高度分化的结合亲和力,可以很好地平衡疗效和毒性,从而避免全身性激活4-1BB的潜在毒性。
2. 康立明生物完成5.6亿元D轮融资,扩展肠癌筛查产品管线
日期:2021-10-15
轮次:D轮
金额:5.6亿元
投资机构:阿里巴巴领投、IDG Capital加持
标签:分子诊断、基因测序、肿瘤早筛
2021年10月15日,广州康立明生物科技股份有限公司(简称“康立明生物”)正式宣布完成5.6亿元规模D轮融资。本轮融资由阿里巴巴领投,老股东IDG资本继续加持,华兴资本旗下华兴新经济基金、基石资本、农银国际、衡庐资产等知名投资机构跟投。
本次融资资金主要用于三个方面,一是拓展产品管线,进一步推动肠癌筛查产品的推陈出新,以及肺癌、膀胱癌、宫颈癌、肝癌等多种高发肿瘤早筛产品的研发设计、临床实验等。二是拓宽销售渠道,加强医疗、大健康和公共卫生领域的布局,开拓国际市场。三是团队建设等。
康立明生物自2015年成立以来,一直致力于长安心(人类SDC2基因甲基化检测试剂盒)等肿瘤早期诊断产品的研发、生产和销售。长安心通过解读粪便中脱落肿瘤细胞的基因异常改变(人类SDC2基因甲基化)进行大肠癌的早期检测,帮助发现患者早期肠癌病变情况,有希望将肠癌阻断在早期阶段,从而达到预防和根治肠癌的目的,并于2018年11月20日荣获中国国家药品监督管理局(NMPA)的批准正式上市。自获批以来,产品已在医院、第三方检测机构、康立明医学检验实验室等进行了超过20万例检测,成为肠癌筛查的重要手段。据公司官网披露,除肠癌外,公司还在肺癌、膀胱癌、肝癌、宫颈癌等多种高发肿瘤早筛产品取得良好进展,在全流程自动化设备研发上进行大量投入,在核心原材料上实现自研自产。
3. 必贝特宣布完成近5亿元股权融资,加速小分子药、核酸药等原研创新药物开发
日期:2021-10-08
轮次:战略投资
金额:近5亿元
投资机构:盈科资本(YINGKE PE)
标签:小分子靶向药、化学小分子
10月8日,广州必贝特医药技术有限公司(以下简称“必贝特”)宣布完成近5亿元股权融资,本轮融资由盈科资本领投。值得一提的是,2015年10月,必贝特新药开发创新团队入选“珠江人才计划”引进创新创业团队;去年5月,必贝特完成数亿元人民币A轮融资。
必贝特于2012年成立于广州,是一家专注于研发治疗癌症和其他重大疾病的原研创新药物的高科技企业。创立至今,该公司已经具备从靶点筛选到化合物设计、从化学合成到新药发现、从临床前研究到临床开发的条件,掌握自主知识产权创新药物设计和研发的核心技术。2021年以来,必贝特新启动的核酸药项目取得重要进展,进入临床前研究阶段。新闻稿显示,目前必贝特成功获得18个临床试验批文,另有5个临床批文药品审评中心(CDE)评审中。目前该公司已拥有11个自主创新一类新药研发项目,包括临床阶段小分子药5个、IND申报阶段小分子药5个和临床前研究阶段核酸药1个。
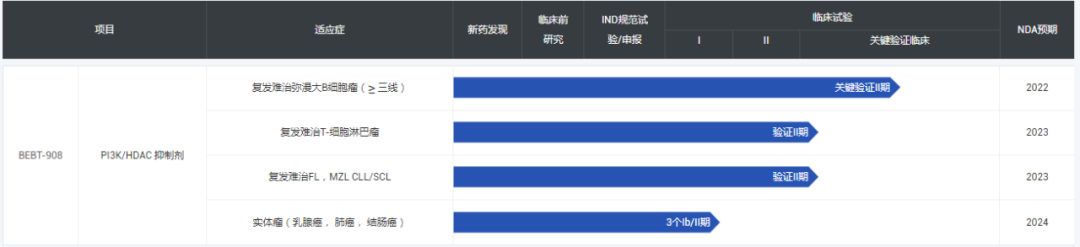
▲必贝特部分研发管线(图片来源:必贝特官网)
必贝特的先导候选药物双替尼他(BEBT-908)是一款同时靶向组蛋白去乙酰化酶(HDAC)和磷脂酰肌醇-3-激酶(PI3K)的双靶点抗癌在研新药,能够选择性抑制具有协同作用肿瘤细胞信使核心靶点,破坏肿瘤细胞信使网络,显著抑制淋巴瘤和骨髓瘤生长或导致肿瘤消退。目前BEBT-908正处于用于复发或难治弥漫大B细胞淋巴瘤的关键验证性2期临床试验阶段,处于用于复发难治T细胞淋巴瘤、滤泡性淋巴瘤(FL)等血液瘤的验证性2期临床试验阶段,处于用于实体瘤(乳腺癌、 肺癌、结肠癌)的1b/2期临床试验阶段。新闻稿显示,BEBT-908预计将于2022年递交新药申请(NDA),有望成为中国首个针对复发难治弥漫大B细胞淋巴瘤的上市小分子创新药。

▲必贝特部分研发管线(图片来源:必贝特官网)
据新闻稿介绍,BEBT-109是全球首个在研泛EGFR突变酶抑制剂,BEBT-109治疗EGFR外显子20插入突变小细胞肺癌正在进行1b/2期临床试验。利用自身项目优势药物和化合物差异性,必贝特还启动了BEBT-109联合BEBT-908治疗接受过第三代EGFR抑制剂治疗后耐药的晚期非小细胞肺癌(NSCLC);
据新闻稿介绍,BEBT-209是一款在研CDK4/6抑制剂,公司正在运用其联合BEBT-908治疗接受过内分泌治疗和CDK4/6治疗后耐药的ER+/HER2-晚期乳腺癌,有潜力突破两大恶性肿瘤对一线和二线治疗耐药后无有效治疗药物的难题;
据新闻稿介绍,BEBT-260是中国首个进入临床试验阶段的第二代细胞周期检查点在研细胞周期检测点激酶1(Chk1)抑制剂;
据新闻稿介绍,BEBT-305是全球首个用于治疗银屑病的在研分子伴侣(Chaperone)抑制剂。
4. 成都安泰康赛种子轮融资近2亿元,推进其治疗癌症的合成致死疗法开发
日期:2021-10-14
轮次:种子轮
金额:近2亿元
投资机构:三江资本
标签:小分子靶向药
近日,成都安泰康赛生物科技有限公司(Anticancer Bioscience,以下简称“安泰康赛”)宣布完成6840万元人民币种子轮延期融资,本轮融资由三江资本(Three Rivers Capital)领投。据新闻稿显示,目前安泰康赛的种子轮融资总额已达近2亿元。本轮融资所得资金将主要用于加速安泰康赛两个先导候选产品Myc-合成致死药物和接触抑制恢复药物的临床前开发,优化多倍体合成致死(synthetic lethality)疗法的先导化合物,以及为该公司恢复癌细胞接触抑制(contact inhibition)疗法确定其他先导化合物。
安泰康赛于2016年成立于成都,是一家国际化的医药公司,致力于应用合成致死方法来开发癌症靶向治疗。安泰康赛的成立是希望将成都毕晓普癌症研究所(MBICR)的基础研究突破转化成更有疗效的、副作用更少的、经济上可负担的抗癌新药。其研发管线建立在迈克尔•毕晓普(J. Michael Bishop)博士——1989年诺贝尔生理医学奖获得者、安泰康赛创始人杨顿(Dun Yang)博士的导师和杨顿博士之间超过15年的合作研究中。新闻稿显示,安泰康赛拥有先进的癌症生物学专业知识和药物发现平台,使该公司能够识别可针对癌细胞的遗传和表观遗传脆弱性的新型化合物。同时,该公司还拥有专有的小分子库,并投资开发了大规模的天然产物库(NP library),为潜在的癌症疗法提供了丰富的筛选资源。
据官网资料介绍,当两种异常(anomalies)的组合导致细胞死亡时,合成致死性就会产生,而单独的任何一种异常都不会。这些异常可以通过基因组拷贝数变化、突变、表观遗传改变产生,也可以通过蛋白质或通路的抑制剂来实现。安泰康赛的药物发现项目由预测性生物标志物驱动,以发现并确定药物先导化合物、药物靶标和预测性生物标志物。其使用等基因细胞系模型、Myc驱动的小鼠肿瘤细胞系和各种人类癌细胞系的组合,在具有明确致癌改变——如Myc癌蛋白的过表达和肿瘤抑制因子p53缺失的细胞中,进行表型筛选展现出选择性致死性的化合物。
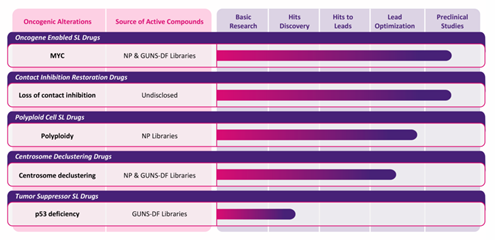
▲安泰康赛的在研管线(图片来源:安泰康赛官网)
据官网资料介绍,安泰康赛专注于Myc蛋白过表达的癌症,这发生在超半数的肿瘤中,并且与低分化和侵袭性癌症相关。Myc是一个尤其令人兴奋的靶点,它不但促进肿瘤细胞的生长,还调节宿主的免疫反应。基于此,安泰康赛利用来自不同平台的、可能会与Myc合成致死的新型化合物,通过其各异的作用机制,单独或与其他临床批准的疗法一起治疗癌症。该公司的两个先导候选产品分别为靶向Myc的合成致死药物和接触抑制恢复药物,目前均处于临床前研究阶段。
安泰康赛创始人、总裁兼首席执行官杨顿博士表示:“本轮融资的成功进一步支持我们为治疗癌症开发潜在‘first-in-class’的创新疗法,并采用合成致死策略。本轮融资是对我们在过去几个月中取得的进展的认可,并将通过优化候选药物选择和推进新药临床试验(IND)支持研究来加速我们的五条管线研发。我们的目标是在2022年启动两项临床试验。”
5. 瑞顺生物完成1.37亿人民币A轮融资,助力创新通用型DNT细胞疗法研发
日期:2021-10-22
轮次:A轮
金额:1.37亿元
投资机构:富汇创投领投
标签:免疫细胞疗法
10月22日,广东瑞顺生物技术有限公司(以下简称“瑞顺生物”)宣布近日完成1.37亿元A轮融资,本轮融资由富汇创投领投,华夏恒天、天堂硅谷、厦门万通金、科发资本等机构跟投。据新闻稿显示,本轮融资资金将用于其创新通用型DNT细胞疗法RC1012注射液的注册临床试验;CAR-DNT、Gene Editing CAR-DNT、iPSC-CAR-iDNT等系列产品管线的临床前研究及新药临床试验(IND)申请等。伴随着A轮融资的圆满完成,其A+轮融资工作已正式启动。
瑞顺生物成立于2012年2月,专注于开发系列治疗血液和实体瘤的创新免疫细胞疗法。据新闻稿显示,该公司拥有自主创新的DNT免疫细胞技术平台,还拥有DNT细胞相关技术的发明专利10多项,并利用DNT细胞平台嫁接CAR-T技术、基因编辑技术、iPSC技术等平台,开发推动新一代系列创新细胞药的临床转化与商业化,产品管线覆盖血液肿瘤、实体肿瘤等未被满足的临床需求。
瑞顺生物的先导候选产品RC1012细胞注射液是该公司自主研发的一款在研创新异体免疫细胞疗法。该细胞疗法从健康捐赠者外周血体外扩增制备而成,富含DNT细胞亚群。据此前新闻稿显示,DNT细胞又称双阴性T细胞(Double Negative T),是正常人外周血中表达CD3分子,但不表达CD4和CD8分子的T细胞亚型,比NK细胞具有更强的特异性杀死复发难治急性髓系白血病(AML)肿瘤细胞的活性和更长的体内持续时间,是一种极有希望用于治疗临床多种肿瘤的通用型T细胞疗法。

▲RC1012细胞注射液临床试验公示(图片来源:中国国家药品监督管理局)
RC1012细胞注射液在2020年11月获得中国国家药品监督管理局新药临床试验默示许可,拟开发适应症为复发难治急性髓系白血病(r/r AML)。据新闻稿显示,这是中国首个进入注册临床试验的非基因编辑异体T细胞药物,目前该临床试验正在浙江大学附属第一医院血液科开展,争取在2022年获得中国国家药品监督管理局药品审评中心“突破性治疗药物”认定,有望成为全球首个上市的拥有自主知识产权的现货通用型DNT细胞药。瑞顺生物现有产品管线中已有10个针对不同血液瘤和实体瘤的在研产品,多个产品即将申报新的IND临床试验。
6. 华夏英泰完成超2亿元人民币B轮融资,加速开发创新型细胞疗法
日期:2021-10-11
轮次:B轮
金额:超2亿元
投资机构:华创资本(China Growth Capital)领投
标签:免疫细胞疗法
10月11日,华夏英泰(北京)生物技术有限公司(以下简称“华夏英泰”)宣布完成超2亿元人民币的B轮融资。本轮融资由华创资本领投,祥峰投资、弘晖资本、道远资本、枫海资本、广州三合悦跟投,老股东汉康资本、源星资本、仙瞳资本、昌发展追加投资。据新闻稿显示,本轮融资的资金将用于公司双靶点血液瘤STAR-T项目的临床试验推进、实体瘤STAR-T管线的开发和临床研究开展等。
华夏英泰成立于2018年3月,是一家聚焦细胞免疫治疗领域,从亟待满足的医疗需求出发,针对多种疾病的产品开发及商业化的创新药研发企业。去年3月,该公司曾宣布完成4500万人民币A轮融资,以进一步推进其CAR-T(嵌合抗原受体T细胞)和工程化T细胞受体T细胞(TCR-T)疗法的开发;今年9月初,华夏英泰上榜中国新技术药物企业创新力TOP30。该公司拥有两大独有技术平台STAR-T和enTCR-T:
STAR的全称为合成T细胞受体抗原受体(Synthetic T cell receptor and Antigen Receptor),它使用CAR胞外结构域中的抗体scFv负责识别并结合抗原,恒定区则为TCR恒定区,保留了TCR的天然活化信号。STAR-T疗法融合了CAR-T与T细胞受体T细胞TCR-T技术的优势,较传统CAR-T疗法治疗血液瘤具有效果更优、副作用更小且易于开发设计多靶点品种的优势,可有效提高T细胞在体内的存活时间、降低T细胞耗竭,防止靶点逃逸和肿瘤复发。
据官网资料介绍,其TCR-T平台以病毒靶点为突破口,后期聚焦新抗原靶点的实体肿瘤治疗,已建立完备的抗原表位预测平台、多人类白细胞抗原(HLA)型的四聚体制备平台、高通量的T细胞受体克隆筛选鉴定平台等,其开发的TCR-T品种已在临床上显示出安全的、良好的治疗效果。华夏英泰目前已与多家中国医院合作启动了十余项备案的“First-in-Human”临床研究,已取得的60多例患者临床疗效数据显示出良好的疗效和安全性。
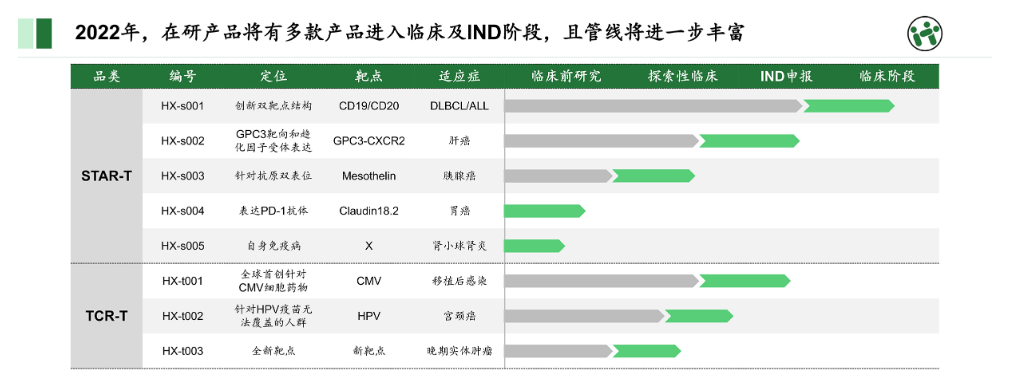
▲华夏英泰的在研管线(图片来源:华夏英泰官网)
据官网资料显示,华夏英泰目前共有8条基于STAR-T平台和TCR-T平台的在研管线,分别针对弥漫性大B细胞淋巴瘤/急性淋巴细胞白血病(DLBCL/ALL)、肝癌、移植后感染、宫颈癌等。该公司的先导候选药物为HX-s001,为双靶点STAR-T疗法,靶向CD19/CD20,拟用于DLBCL/ALL患者,现已进入临床阶段。在TCR-T领域,华夏英泰研发了靶向巨细胞病毒(CMV)的创新药物HX-t001,拟用于治疗移植后感染,目前正处于新药临床试验(IND)申报阶段。
7. 卡替医疗完成逾亿元Pre-B补充轮融资,推动“超强型TIL”免疫细胞治疗技术研发
日期:2021-10-01
轮次:Pre-B轮
金额:逾亿元
投资机构:建兴基金、新浚资本
标签:免疫细胞疗法
10月2日,北京卡替医疗技术有限公司(以下简称“卡替医疗”)宣布完成逾亿元Pre-B补充轮融资,本轮融资由新浚资本领投,建兴医疗基金等机构跟投。
卡替医疗成立于2015年,总部位于中国北京,是一家致力于研发肿瘤浸润淋巴细胞(TIL)/新抗原等创新免疫细胞疗法的生物科技企业。据官网资料介绍,卡替医疗拥有靶向CD19、CD20、B细胞成熟抗原(BCMA)、NY-ESO1等的CAR-T、TCR-T技术,以及个体化多靶点的肿瘤新抗原(neoantigen)免疫治疗技术,已形成了高通量基因测序(NGS)与CAR-T等前沿细胞治疗技术相结合的肿瘤诊疗一体化模式。
卡替医疗首席科学官(CSO)高斌教授曾任全球TCR-T领域代表性公司Adaptimmune首席科学家。新闻稿显示,该公司自主研发的“超强型TIL”免疫细胞治疗技术致力于攻克实体肿瘤,可通过“增强受体”和“扩增因子”等专利技术,对TIL细胞进行基因改造,在理论上突破了传统CAR-T/TCR-T/TIL疗法的诸多局限,解决关于实体瘤的异质性、微环境,以及细胞扩增工艺、制备周期和成本的诸多难题。
今年2月该公司的Pre-B轮融资新闻显示,该融资将用于支持卡替医疗公司的“超强型TIL”细胞治疗产品完成IND申报。“超强型TIL”产品用于治疗晚期传统治疗无效实体瘤,已进行概念验证(POC)临床研究并取得积极结果。目前,由上海东方医院李进教授、北京肿瘤医院郭军教授、北京协和医院赵海涛教授、郑大一附院张毅教授等知名研究者主导的“超强型TIL”用于不同实体瘤适应症的、甚至不限癌种的新一轮临床试验正在进行中。新闻稿显示,该公司研发的第四代产品“超强型cTIL”仅需采集外周血中的TIL细胞,突破了传统TIL疗法依赖于手术组织取材的局限,极大地拓展了适用人群。
参考资料:
[1]盈科资本战略领投必贝特加码全原研创新药标杆企业. Retrieved 2021-10-08, https://mp.weixin.qq.com/s/_zmvO7jBmjCUmU0Zk_-ktA
[2]Anticancer Bioscience Welcomes New Investor into Seed Financing Round Bringing Total Raised to Over $31m to Advance Synthetic Lethality Approaches to Cancer Therapy. Retrieved 2021-10-14, from https://www.businesswire.com/news/home/20211014005021/en
[3] RC1012细胞注射液临床试验公示. Retrieved 2021-10-22, http://www.chinadrugtrials.org.cn/clinicaltrials.searchlist.dhtml
关于召开第七届七次理事会暨会长办公会
各相关单位: 经研究,四川省医..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..认真落实巡视组反馈意见,进一步规范协
按照四川省市场监督管理局党组巡视..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于召开会长办公会的通知
各会长、副会长单位: 根据四川..四川省医药保化品质量管理协会组织召开
2025版《中国药典》将于2025年10月..四川省医药保化品质量管理协会召开第七
四川省医药保化品质量管理协会第七..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..