千呼万唤始出来,基药目录调整终于有了新动作!
11月15日,卫健委药政司发布关于就《国家基本药物目录管理办法(修订草案)》公开征求意见的公告(以下简称“修订草案”)。
虽然没有提及下次基本药物目录到底何时更新,但从修订草案发布的时间来看,2021年几乎已经无望。
修订草案2442个字,粗中有细,明确了此前业界关注的几个要点:3年一更新,配合适时调整;儿童用药目录终从探讨到落地;独家品种要经过单独论证;临床综合评价是基药调入调出的重要依据之一。
修订草案第十二条明确,国家基本药物目录坚持定期评估、动态管理,调整周期原则上不超过3年。必要时,经国家基本药物工作委员会审核同意,可适时组织调整。
儿童用药方面,按照修订草案的描述:“国家基本药物包括化学药品和生物制品目录、中药目录和儿童药品目录等。”这意味着基药目录中,会有单列出儿童用药目录,这是此次
文件中较为明确的表示。此前基本药物目录的更新,虽然一直以来比较重视儿童用药的纳入和比重,但是儿童药品目录还是第一次。
2018年版基药目录,儿科用药是作为化学药品和生物制品目录、中药目录的子类呈现。其中化药为3个,中药为12个。当然,这里需要明确的一点是,儿童用药和儿科用药的内涵差异,也就是修订草案里所描述的 “儿童药品主要依据儿童专用适用药分类”,这句话明确的内容是儿童用药的分类方式是专用适用药。但众所周知,不管是中药还是化药,儿童药有很大一部分都是在成人药用药基础上演变而来,这类药物在基药目录更新中该如何处理,值得关注。
文件中表示,“独家生产品种纳入国家基本药物目录应当经过单独论证。”按照行业内的通常表示,独家品种一般在使用语境中,大部分指中药。从过往政策导向上看,部分中药在临床综合评价的条件下,确实会在纳入上存在挑战。
已经纳入的会不会被调出?答案是肯定的。修订草案明确了两类调出情况:
(一)发生严重不良反应,或临床诊疗指南、疾病防控规范发生变化,经评估不宜再作为国家基本药物使用的;(二)根据药品临床综合评价或药物经济学评价,可被风险效益比或成本效益比更优的品种所替代的。
“独家品种”还有哪些内涵?事实上,产业界也存在一些化药“独家品种”,这类产品大多是在特定的历史条件下改盐、改酸根、改晶型等形成的,只有一家生产,没有仿制药产品。“独家品种”是否涵盖此类,也值得关注。
此外,一位长期关注基药目录的行业专家表示,一些新进获批的创新药事实上也是独家品种。
临床综合评价要重视起来。文件中提到四次“临床综合评价”,是基药调出调入的主要依据之一。
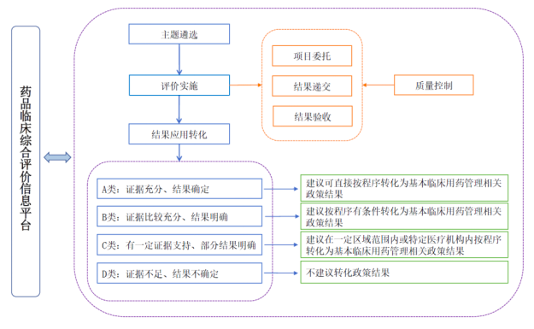
今年7月28日,国家卫健委发布《药品临床综合评价管理指南(2021年版试行)》(以下简称“《评价指南》”),适用于国家和省级卫生健康部门基于遴选疾病防治基本用药、拟定重大疾病防治基本用药政策、加强药品供应管理等决策目的,组织开展的药品临床综合评价活动。
综合评价主要聚焦药品临床使用实践中的重大技术问题和政策问题,围绕技术评价与政策评价两条主线,从安全性、有效性、经济性、创新性、适宜性、可及性6个维度开展科学规范的定性定量相结合的数据整合分析与综合研判。按照《评价指南》公布的临床综合评价流程,其结果应用转化分为A、B、C、D四类,其中A类为证据充分、结果确定,转化结果是建议可直接按照程序转化为基本临床用药管理相关政策结果;B类为证据比较充分、结果明确,转化结果为按照程序有条件转化为基本临床用药管理相关政策结果;D类为证据不足、结果不确定,此类不建议转化为政策结果。
除了以上信息外,能够看到修订草案为接下来的实际工作留下了空间。比如,在“调整的品种和数量”影响因素第六条为:“国家基本药物工作委员会规定的其他情况”,而其他情况的具体内涵是什么?并没有更细化的内容描述。
