基因治疗再遇挫折。两起基因疗法先后暂停相隔不过一周,一起被发现患有肝细胞癌和腺瘤,一起是严重的肝毒性。一家为AAV基因疗法被叫停的“常客”安斯泰来,另一家为拜玛林。
01 叫停!一例肝癌一例严重肝毒性
FDA又叫停了一起AAV基因疗法。
9月6日,美国BioMarin(拜玛林)公司宣布,FDA暂停了其AAV基因疗法BMN307的phaless 1/2期临床研究,同时该公司将暂停这项临床全球1/2期研究患者的进一步招募,直到调查完成。
BMN307是一项用于治疗苯酮酸尿症(PKU)的在研基因疗法,载体采用的AAV基因,表达苯丙氨酸羟化酶(PAH)。为了解BMN307活性在具有两种生殖系突变的小鼠中的持久性,BioMarin展开了这项临床前研究。
研究结果显示,在63只接受治疗的动物中,使用最高剂量BMN307的7只动物中有6只在给药 52 周后进行肝脏剖检发现肿瘤,这表明AAV载体的部分整合到基因组中。其中5只患有腺瘤,1只患有肝细胞癌(HCC)。但给药24周时,所有小鼠均未观察到损伤。
不过迄今为止,拜玛林在phaless I/II 期临床研究仅给人低剂量的低剂量2e13 vg/kg或6e13 vg/kg,由于AAV整合导致的癌症尚未在大型动物或人类中观察到。
三一创新投资管理合伙人尹正表示,过往采用腺病毒载体(AV)造成了很严重的安全性问题,后来改良成的AAV病毒,相比AV来说,AAV最大的优势是一般在人体内只复制,不发生整合,所以安全性比AV更高。
该公司正在与FDA和其他卫生部门合作,进一步评估已服药的研究参与者,继续对他们进行长期监测,并在可行时就BMN307的下一步进行沟通。
“已有3000多名患者接受了基因治疗,目前还没有相关癌症的报道。本周FDA讨论强调了这个问题的复杂性,我们已经在使用其他AAV载体的小鼠中观察到了整合突变和由此产生的癌症形成,因此我们计划调查这些发现。”BioMarin全球研发总裁Hank Fuchs博士说。
拜玛林是90年代成立的代表性Biotech,如今成为用基因治疗罕见病的“小而专、小而美”。与其同期成立的还有Alexion、蓝鸟生物、Seagen等,如今也都成为了生物新贵。其创始人和一系列高管均是基因泰克出来的,自1997年成立以来拜玛林开发并推出了7种针对遗传病的药物。其中针对PKU的就有两款,分别为Kuvan(小分子药)和Palyniq(新型酶疗法)。
2015年 9 月,拜玛林宣布已在用于A型治疗血友病患者的基因疗法BMN 270的 1/2 期试验中招募了首位患者。这是拜玛林首次公开其基因治疗方向上的进展。2019年9月,拜玛林向英国药品和保健产品监管机构(MHRA)提交基因疗法BMN307的临床申请,这是其第二个AAV基因疗法产品。
去年8月,拜玛林的血友病基因疗法被FDA拒绝,主要原因是该疗法I期和II 期临床试验研究中仅对少数患者进行了数年的随访。由于该公司试验的患者之间存在差异,FDA 担心其耐久性。
而在此前也发生过多起AAV致死事件。据统计,仅2020年一年AAV基因疗法已经导致了4 例致死,其中3例来自日本安斯泰来的子公司 Audentes Therapeutics,患者虽分别死于败血症和胃肠道出血,但根本原因是接受了高剂量的治疗。值得关注的是,在这三起致死事件中,患者均出现了肝脏疾病。9月1日,安斯泰来还因严重的不良反应(肝毒性)暂停了基因疗法AT132的临床试验。
今年5月,美国基因疗法公司Adverum也暂停了一项针对糖尿病性视网膜病变黄斑水肿(DME)的 II 期临床试验INFINITY,原因是一例受试者在接受单次高剂量治疗 30 周后,出现了眼压过低、全葡萄膜炎以及视力丧失症状。“眼睛使用的剂量非常小,因而毒性作用极小”一位国内眼科基因疗法专家之前对E药经理人表示。这也使得眼睛成为基因疗法的黄金部位。
美中药源表示,高剂量AAV通常是表达足够蛋白的先决条件,但达到治疗剂量不仅容易带来各种严重毒性,而且也对AAV的生产和质量控制带来极大挑战,因为浓缩会增加各种杂质包括其它病毒和致癌DNA的浓度。
02 FDA召开会议讨论解决办法?
FDA同样重视到安全问题所带来的的困境。
9月2日~3日,FDA召开了为期两天的“马拉松式”专家咨询委员会会议,重点讨论了“常见的”基因治疗中可能的安全风险,尤其关注到腺相关病AAV。
20 年前一系列挫折曾一度让基因疗法陷入停滞不前的困境。以AAV为代表的递送技术的改进解决了其中部分问题使得基因疗法有了长足的发展。仅2020年就有超过40种使用这些递送技术的基因疗法在开展人体试验之前提交给FDA进行早期咨询,并且提交临床的数量也不断在增加。
但随着AAV疗法适用范围的扩大,严重的副作用引发安全问题的报道也不断见诸报端。FDA 引用最近的研究发现大约三分之一的 AAV基因治疗试验存在“在治疗中出现的严重不良事件”。
FDA在肯定这些基因疗法作为开创性疗法的前景和贡献,但面对走向市场以及在早期临床试验中频频出现患者死亡的现状,监管机构同时提到了从肝毒性到肾损伤再到神经元损失的诸多有待解决的安全问题。
专家咨询委员会会议试图回答人体肝毒性风险、临床前动物研究的优点和局限性、如何筛查肝脏不良事件、是否应该限制载体剂量、基因治疗本身应该使用哪些策略来降低风险等等一系列复杂问题。
参会演讲者名单十分豪华,其中包括基因疗法先驱Jim Wilson。
1999年,患有严重遗传病鸟氨酸转氨甲酰酶缺乏症的18岁少年Jesse Gelsinger,在接受宾夕法尼亚大学人类基因治疗研究所所长Jim Wilson教授主导的腺病毒基因治疗临床实验后,发生严重免疫反应后死亡,成为第一个因基因治疗而死的人。
这场悲剧在夺去少年生命的同时也瘫痪了整个基因治疗领域。Jim Wilson被剥夺了头衔解散了团队,并被禁止再进行任何临床试验直到2010年。重回研发舞台后,Jim Wilson带着他的技术帮助创建了RegenxBio 、Passage Bio等多个生物技术公司。
不过对应用越来越广AAV疗法,Jim Wilson也持更加谨慎的态度。他常常呼吁研究人员对AAV疗法对肝脏和神经的损伤进行更多监测,在本次咨询会上发表两个单独的演讲侧重于临床前研究中的肝脏或神经系统副作用。
FDA也公布了针对两种基因疗法——诺华旗下治疗SMA(脊髓性肌肉萎缩)Zolgensma和Spark Therapeutics用来治疗遗传性视网膜疾病Luxturna的一份报告,两者都使用腺相关病毒AAV将治疗基因递送给患者。
报告中称,自 Zolgensma 获批以来,接受 Zolgensma 治疗的500名患者中约有三分之一发生了肝脏相关不良事件,其中包括1例严重肝功能衰竭。
诺华则是唯一一家正式出席咨询委员会会议的企业。作为Zolgensma的生产商诺华的报告主要围绕该药物上市后试验期间出现的不良事件,公布了部分详细信息。
报告以三例罕见凝血综合征病例展开,截至目前在接受过Zolgensma剂量治疗的1400名脊髓性肌萎缩症患者中有9名发生血栓性微血管病(TMA),这是一种罕见病,可导致血小板降低、器官损伤和其他严重并发症严重时可能会导致死亡。试验中还有一名患者死于败血症。
诺华表示,基因疗法倾向于治疗罕见的、危及生命的疾病,鉴于目前已知的风险应尽早对患者进行TMA筛查并立即实施治疗。并建议将风险警告添加到未来AAV基因治疗的药物标签中。
FDA 对专家提出的问题涵盖了很多方面,咨询委员会在听取跟各方意见的同时也进行了大量讨论,
有专家表示应对接受基因治疗进行更正式的风险评估,对潜在肝病患者建立长期随访研究;有专家建议FDA应该对基因治疗剂量的大小设定上限;有专家则表示狗可能是未来评估癌症或肝损伤的风险的最佳临床前模型。
美国医药媒体BioPharma Dive表示,在基因治疗方面FDA 和制药企业都仍处在学习阶段,对会议的很多结论都持开放式的态度,但讨论为FDA的思考方向提供了线索。
“对于这些事件,原因究竟是AAV病毒载体的系统性问题,还是单个产品的问题,现在没有更多的证据支撑。这就是科学的未知性。”尹正说道。
要放弃AAV吗?这不太现实。据Nature Reviews Drug Discovery披露,目前约有238个基于AAV的细胞与基因治疗临床试验正在开展,是临床试验中使用最多的病毒载体之一。
两年前,Jim Wilson曾直接表示过对AAV的看法“根据我过去三十年的经验,AAV 仍是最安全的递送系统之一。我们应该对任何生物制品保持期望,但如果将剂量推到足够高的水平就会出现剂量限制性毒性的情况。”
低剂量无效,高剂量致死,AAV基因疗法到底何去何从?前述眼科基因疗法专家给出三个建议:一是筛选更加特异更高效率的 AAV;二是优化AAV衣壳,解决空衣壳杂质问题,FDA和外部专家都担心,空衣壳会不必要地让患者接触到更多的外来蛋白质,增加免疫原性,从而引起基因治疗的安全性问题。三是结合其他技术手段如DNA编辑、RNA编辑来降低AAV毒性和免疫原性。
03 国内尚处鸿蒙阶段
尽管有诸多“阴霾”事件发生,但这就是科学。
尹正认为:“现阶段,我认为全球以病毒为载体的基因治疗目前处于Gartner技术成熟度曲线的右侧,正处于产业化的路上,是一个慢慢爬坡成长的过程。”
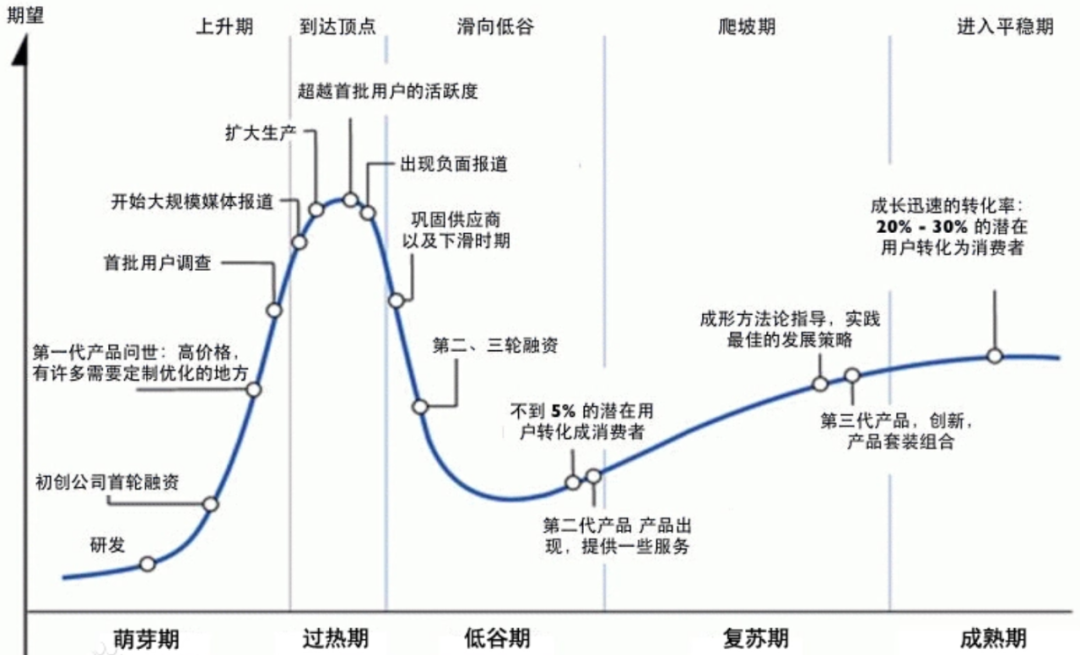
图 | Gartner技术成熟度曲线
而国内以病毒为载体的基因治疗又是怎样的境况呢?
2008年,一篇标题为:《基因治疗Leber’s先天性黑蒙症的安全性和有效性研究》在《新英格兰医学杂志》发表,拉开了全球眼科基因治疗技术的序幕,也带给了太平洋彼岸一阵风。
一位有预见的年轻人敏锐地意识到,基因治疗将会成为一个改变时代的机遇。于是他决定以Leber’s遗传性视神经病变(LHON,线粒体相关疾病)为突破口,投身基因治疗行业。他就是后来的纽福斯创始人兼董事长李斌。“找方向找了一年,决定只花了1秒。”
2011年,在行业前途未明的情况下,李斌启动了全球首例针对Leber’s遗传性视神经病变的基因治疗临床试验,也拉开了中国眼科基因治疗的序幕。
当时中国真正从事技术性的基因治疗很少,几乎没有。从现在来看,国内尚在鸿蒙阶段,虽然已有多家企业在布局,但都处在研究阶段,上临床的很少。纽福斯是一家,信念医药是另一家。今年3月纽福斯自主研发的NR082获批IND,成为国内首个获IND的眼科体内基因治疗药物;8月,信念医药宣布其自主研发的BBM-H901获批临床试验批准,这是国内第一个获批进入注册临床试验的血友病AAV基因治疗药物。
尹正也一直在找寻符合投资策略的基因疗法项目,包括做罕见病的、做眼科的,还有做AAV载体修饰的,以及基因治疗CXO公司。“关注了很长时间,一直在调研这个领域,但没有找到特别符合我们投资策略的基因治疗项目。从技术储备来说,以病毒为载体的基因治疗有他的逻辑性和合理性。但每个领域都要找到好的应用场景,用基因治疗做罕见病、做眼科都是挺好的想法,国外也有相当不错的案例。”
认真落实巡视组反馈意见,进一步规范协
按照四川省市场监督管理局党组巡视..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于召开会长办公会的通知
各会长、副会长单位: 根据四川..四川省医药保化品质量管理协会组织召开
2025版《中国药典》将于2025年10月..四川省医药保化品质量管理协会召开第七
四川省医药保化品质量管理协会第七..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..学习传达中央八项规定精神专题会议
2025年4月22日,协会党支部组织召..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..