呼吸道合胞病毒(RSV)感染是全世界范围内5岁以下儿童急性下呼吸道感染的重要原因,也是婴儿死亡的主要原因之一,呼吸道合胞病毒感染不仅可能加重原有的慢性呼吸系统疾病,也可能引起反复喘息发作等后遗症,给全球儿童卫生健康造成重大影响及负担。
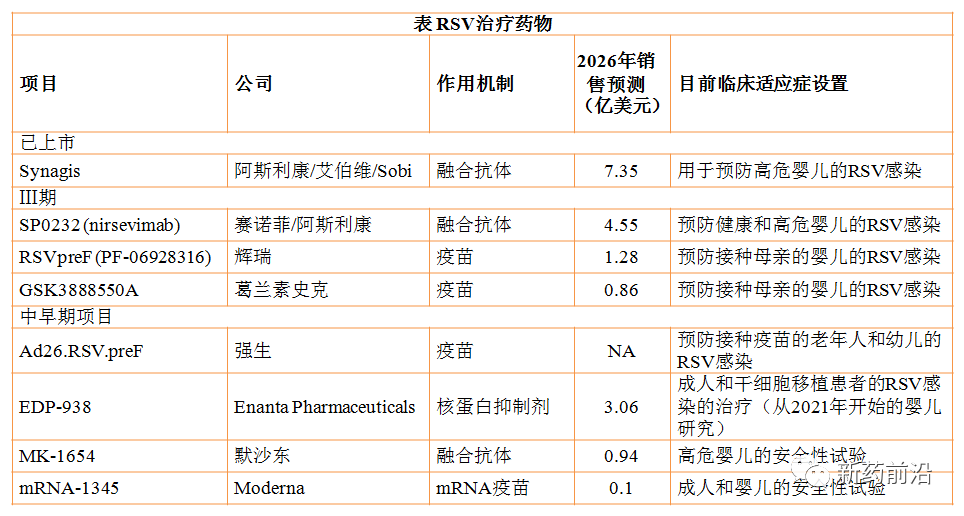
临床上,用于预防或治疗呼吸道合胞病毒感染的药物较少。MedImmune(已被阿斯利康收购)开发的呼吸道合胞病毒F蛋白抑制剂单克隆抗体Synagis(palivizumab,帕利珠单抗)于1998年获美国食品药品管理局(FDA)批准后,在近22年内再没有批准该适应症的新药,这一事实凸显了呼吸道合胞病毒药物开发领域所面临的挑战。呼吸道合胞病毒领域的新药研发尽管屡屡遭遇失败,但目前也有多种进入临床试验阶段药物取得了积极进展。
可惜的晚期失败者
呼吸道合胞病毒新药研发最近的失败包括Novavax的Resvax(已在两项关键研究中遭遇失败)和再生元的suptavumab(已进入Ⅲ期,然后于2017年被放弃)。而十年前,Synagis的潜在替代药物motavizumab出于安全原因被FDA拒绝。
Novavax研发的ResVax是一种以磷酸铝为佐剂的RSV融合(F)蛋白重组纳米颗粒疫苗,该公司期望开发通过免疫孕妇使婴儿获得RSV抵抗力的免疫方法。2019年2月,Resvax在其第二项Ⅲ期Prepare研究中遭到重磅一击:该项试验结果表明,未能在婴儿出生后的90天之内降低医学上重要的RSV下呼吸道感染发生率的主要终点。在2016年一项更大规模的Ⅲ期研究中,ResVax在老年患者群体中未能达到预防中重度呼吸道合胞病毒下呼吸道感染(LRTI)的主要终点。
再生元的suptavumab是一种全人源化单克隆抗体,利用再生元的Velocimmune技术开发,靶向呼吸道合胞病毒的融合蛋白(RSV-F)。2017年8月,评估suptavumab(REGN2222)预防呼吸道合胞病毒感染的一项Ⅲ期临床研究NURSERY Pre-Term未能达到在婴儿中预防呼吸道合胞病毒感染就医的主要终点。此外,suptavumab在一个亚组患者中也未能表现出疗效迹象。安全性方面,suptavumab和安慰剂之间的不良事件相似。基于该结果,再生元已决定终止suptavumab的进一步临床开发。
阿斯利康收购MedImmune获得的另一种研究性单克隆抗体motavizumab用于预防高危儿科患者呼吸道合胞病毒引起的严重疾病。阿斯利康本打算用motavizumab作为Synagis替代产品。FDA基于安全性考虑对motavizumab的上市申请分别于2008年11月(严重的过敏性过敏反应问题)和2010年9月(未在美国人群中对该药进行测试,而motavizumab未能显示出明显优于Synagis的非劣效性,从而减少了住院人数,并引起了比Synagis更严重的副作用,需要增加其他临床试验提供证据,以支持需要预防性适应证的人群中令人满意的风险/益处)发出了两份完整的回复函。其中在2010年6月,FDA抗病毒药物咨询委员会也以14票反对3票赞成,不建议批准motavizumab。
晚期项目谁会胜出
目前已上市的Synagis尽管价格高昂,五个月的剂量治疗方案复杂以及对其使用的限制意味着该抗体并未被临床广泛使用。但根据全球医药健康领域领先的行业咨询及市场调研机构Evaluate Pharma的预测,Synagis销售额将在2026年仍达到7.35亿美元。因此,巨大的潜在市场让葛兰素史克等公司再次尝试该领域。
由于最近有关疫苗开发的许多新闻都集中在Covid-19上,11月23葛兰素史克启动其呼吸道合胞病毒候选疫苗GSK3888550A用于母体免疫安全性和有效性的Ⅲ期GRACE研究(NCT04605159)并没有引起业界广泛关注。
在葛兰素史克GRACE研究中,将为10000名孕妇提供GSK3888550A或安慰剂,主要终点是减少婴儿出生后六个月内的下呼吸道感染。该研究预计将于2024年初完成,并于2022年公布中期结果。
并非只有葛兰素史克对该领域感兴趣,鉴于任何成功的产品都有望满足该疾病临床的高度需求。辉瑞和赛诺菲同样也有处于晚期开发阶段的候选药物,进入Ⅱ期临床试验阶段的候选药物还有更多。所有参与其中的公司都希望避免造成原先竞争者那样的失败。
辉瑞,默沙东和莫德纳(Moderna)也采用了这种被动疫苗接种方法,旨在通过母亲的接种而确保孩子出生时能预防呼吸道合胞病毒感染。
辉瑞目前略有领先:PF-06928316(RSVpreF)的关键性Ⅲ期试验于今年6月开始,在美国和其他几个国家对约6900名18-49岁孕妇进行安慰剂对照试验,并将追踪接种后新生儿出生后六个月内呼吸道感染的呼吸道感染率以及潜在的副作用等。预计于2023年下半年完成,并可能在2022年公布中期数据。2018年11月,这种RSV疫苗已经获得美国FDA的快速通道认定。
默沙东和莫德纳最近结束了成人呼吸道合胞病毒疫苗的合作,目前正在单独开展项目。其中Moderna计划将其mRNA候选疫苗RSV mRNA-1345与抗人偏肺病毒和3型副流感病毒的候选疫苗mRNA-1653结合使用,以期一次性预防所有三种疾病。但是,该项目还处于早期阶段。
赛诺菲与阿斯利康合作开发的单克隆抗体nirsevimab(SP0232),与Synagis一样旨在为出生后不久的婴儿提供预防性环境。今年7月30日,国际权威医学期刊《新英格兰医学杂志》发表了nirsevimab的Ⅱb期研究结果看起来不错,严重下呼吸道感染减少了70%,住院治疗减少了78%。nirsevimab使用扩展技术来延长其半衰期;赛诺菲声称,nirsevimab可以提供至少六个月(相当于被动疫苗接种)保护,并可能使受到RSV相关下呼吸道感染的侵害保护期长达12个月。与母体疫苗相比,这可能使nirsevimab更适合于呼吸道合胞病毒的季节性特性:该药的使用可以更准确地针对一年中病毒更普遍的时期。
nirsevimab目前正在进行两项Ⅲ期试验,一项针对高危早产儿的Synagis对照研究(Medley),另一项针对健康婴幼儿的安慰剂对照研究(Melody)。这些研究将分别在2022年和2023年公布数据。
呼吸道合胞病毒的药物开发历史表明,这是一个高风险领域。但至少到目前为止,处于晚期试验中有几种疗法极具希望,如能够取得成功,将会获得庞大市场。
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..