通过降解特定蛋白治疗疾病的蛋白降解疗法是近年来广受关注的研发领域。日前,罗氏(Roche)与Vividion Therapeutics公司刚刚达成一项数十亿美元的研发协议,利用Vividion公司的蛋白质组学筛选平台和小分子数据库,开发创新蛋白降解疗法。上周,专注于开发蛋白降解疗法的Monte Rosa Therapeutics公司也脱颖而出,完成数额为3250万美元的A轮融资。除此以外,多家全球性医药公司也在这一领域积极布局,通过与聚焦开发蛋白降解疗法的生物技术公司合作,探索治疗多种疾病的新治疗模式。
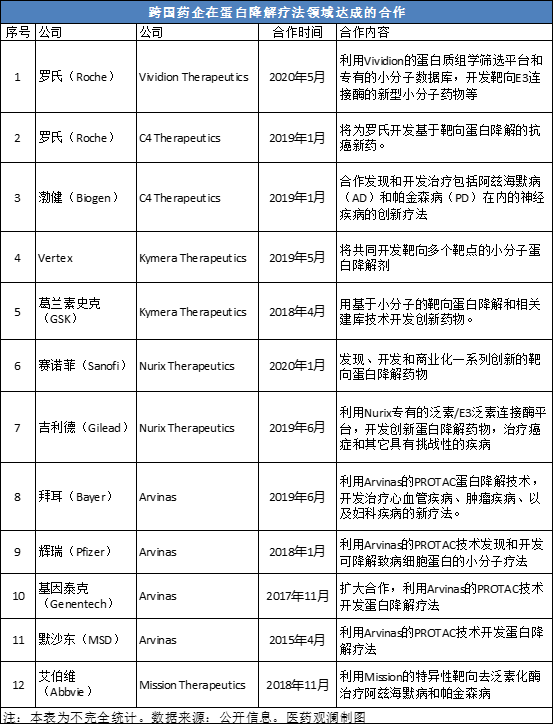
在今年的ASCO年会上,Arvinas公司和百时美施贵宝(BMS)公司都公布了各自开发的蛋白降解疗法的初步人体试验临床结果。下面我们来看一下这两项临床结果对蛋白降解开发领域有什么启示。
利用细胞的“垃圾处理站”
人体的细胞中存在着天然的“垃圾处理站”,它叫做泛素-蛋白酶体系统(ubiquitin-proteasome system, UPS)。在细胞中,它会降解折叠错误或不再需要的蛋白质,破损的细胞器,回收氨基酸来合成新的蛋白质。在泛素-蛋白酶体系统中,细胞会给需要降解掉的蛋白质添加上一些泛素分子,这就好像是给“垃圾”打上了“可回收”的标记。然后,这些被泛素标记的蛋白质会被送到细胞内的蛋白酶体中进行处理。
而蛋白降解疗法的原理是将特定蛋白与添加“标签”的泛素连接酶连接在一起,为这些蛋白打上“可回收”的标签,将它们运送到蛋白酶体系统中进行降解,从而达到治疗疾病的目的。
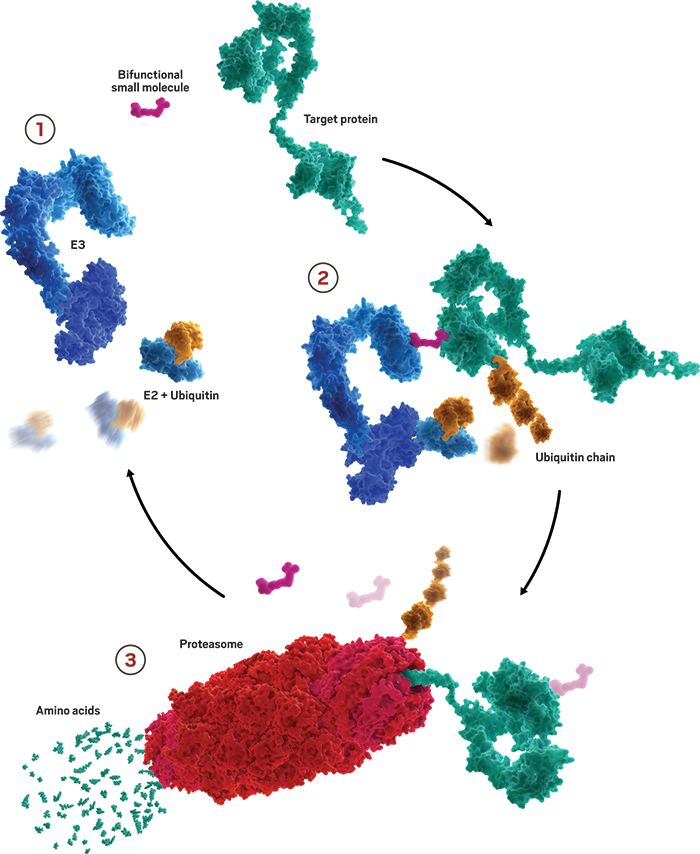
▲蛋白发生降解的过程(图片来源:Kymera Therapeutics)
这一疗法的优势在于,它可以用于靶向那些“不可成药”的蛋白靶点。传统的小分子药物需要与蛋白的催化位点或影响蛋白功能的“口袋”相结合,而很多致病蛋白缺乏这些位点。靶向蛋白降解剂理论上可以通过与蛋白上的任何角落相结合来引发对蛋白的降解,因此被视为靶向“不可成药”靶点的重要策略之一。
那么,这些结构独特的分子在人体中的安全性如何?在人体中它们能够有效地降解靶点蛋白么?在治疗疾病方面,它们又有什么样的表现?Arvinas和BMS公布的初步结果开始对这些问题做出解答。
Arvinas公司的雄激素受体蛋白降解疗法ARV-110
Arvinas公司开发的ARV-110是一款靶向雄激素受体的蛋白降解疗法。在一项1/2期临床试验中,总计22名患有去势抵抗性前列腺癌(mCRPC)的患者接受了不同剂量的ARV-110的治疗。这些患者已经接受过多种前期疗法的治疗,包括enzalutamide和abiraterone等。
在22名患者中,20名患者的前列腺表面抗原(PSA)应答能够被评估,其中12名患者接受ARV-110的剂量超过140 mg。在这12名患者中,两名患者的PSA水平降低超过50%。值得一提的是,对患者循环肿瘤DNA的分析发现,12名患者中,5名患者携带的雄激素受体出现的基因突变导致它们无法和ARV-110相结合。2名PSA水平降低超过50%的患者携带的雄激素受体能够与ARV-110结合。
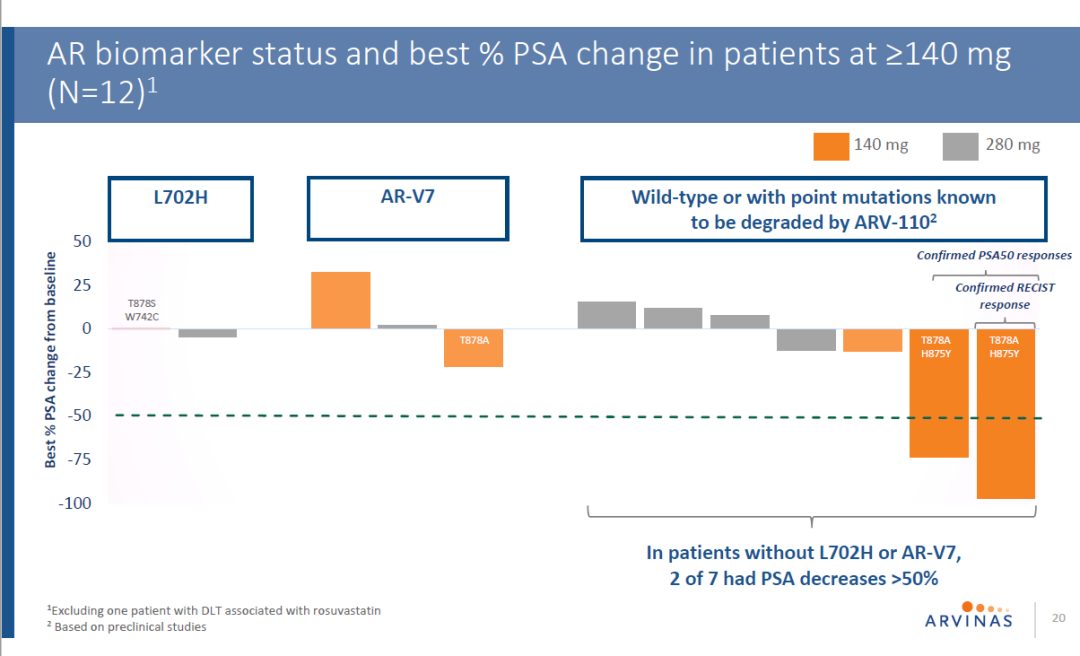
▲接受剂量大于140 mg的ARV-110治疗的患者的PSA应答(图片来源:参考资料[3])
其中,一名患者的PSA水平与基线相比降低97%,而且肿瘤体积与基线相比缩小80%。他在接受治疗后,已经18周没有疾病进展。另一名患者的PSA水平降低74%,在数据截至时已经维持30周没有疾病进展(这名患者在基线时根据RECIST标准没有检测到病灶)。这两名患者的雄激素受体都携带着让他们对其它疗法产生耐药性的突变(T878A和H875Y)。
在安全性方面,在两名患者中发现ARV-110与rosuvastatin(ROS)的潜在药物相互作用。一名同时服用rosuvastatin的患者在接受剂量为280 mg的ARV-110治疗后出现4级剂量限制毒性和急性肾衰竭。第二名患者在接受70 mg ARV-110治疗后出现3级肝脏AST/ALT酶水平升高,停止使用rosuvastatin后症状消失。ARV-110在其它20名患者中表现出良好的安全性和耐受性。目前1/2期剂量递增试验已经禁止在服用rosuvastatin的患者中用药,并探索420 mg的用药剂量,力图发现在2期临床试验中使用的最佳剂量。
百时美施贵宝公司的CRBN调节剂CC-92480
百时美施贵宝公司开发的蛋白降解疗法CC-92480源于治疗多发性骨髓瘤(MM)的获批疗法来那度胺(lenalidomide)。它和类似物泊马度胺(pomalidomide)治疗MM的作用机制之一是通过与名为CRBN的E3泛素连接酶结合,导致它降解Ikaros和Aiolos等转录因子,从而达到免疫调节和抗肿瘤的效果。
研究人员以来那度胺为基础,设计出蛋白降解能力更强的CC-92480。在体外细胞培养试验中,他们发现,降解剂降解Aiolos转录因子的能力越强,越能够迅速导致多发性骨髓瘤细胞系的死亡。
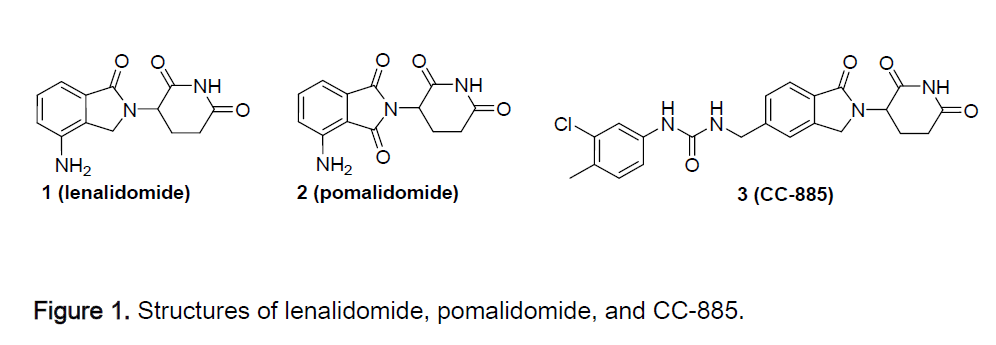
图片来源:参考资料[6]
在ASCO公布结果的1期临床试验中,平均已经接受6种前期治疗的复发/难治性MM患者接受了不同剂量和给药方案的CC-92480的治疗。这些患者已经接受过来那度胺、泊马度胺、以及抗CD38抗体等前期疗法的治疗。
试验结果表明,在接受最佳给药方案的11名MM患者中,CC-92480达到54.4%的客观缓解率(ORR),其中包括一名完全缓解(CR),一名很好的部分缓解(VGPR)。这一组的患者中,CC-92480在给药3小时之后,就能够将Aiolos的水平降低93%。
希望和挑战
从在ASCO年会上公布的两款蛋白降解剂的初步临床试验数据表明,蛋白降解疗法在人体试验中首次展示出成功降解靶点蛋白,并且改善患者症状的效果,为这一创新治疗模式从临床前研究转化到临床期研究提供了“概念验证”。
虽然理论上蛋白降解疗法对药物与靶点之间结合位点的要求比传统小分子抑制剂更为宽松,但是开发成功的蛋白降解剂的关键仍然是需要找到能够与靶点蛋白相结合的化合物。去年Nature Reviews Drug Discovery的一篇综述也将找到与蛋白结合的化合物作为蛋白降解疗法开发需要克服的重要挑战之一。Arvinas公司的临床试验结果表明,雄激素受体中可能出现让它们无法与ARV-110结合的突变。如果想要治疗这些患者,需要开发出新的蛋白降解剂。Arvinas公司已经开发出一款替代雄激素受体降解剂,目前它在支持IND申请的临床前研究阶段。
而携带特定突变的雄激素受体对ARV-110的降解作用更为敏感的观察提供了一个新的可能性,那就是通过对患者进行基因测序,找出潜在最适合这一蛋白降解疗法的患者。
我们期待蛋白降解剂在人体临床试验中获得的初步成功,能够激发这一领域对蛋白降解疗法的进一步优化,让它在未来发挥出改变疾病治疗模式的力量。
参考资料:
[1] First-in-human phase I study of the novel CELMoD agent CC-92480 combined with dexamethasone (DEX) in patients (pts) with relapsed/refractory multiple myeloma (RRMM). Retrieved May 31, 2020, from https://meetinglibrary.asco.org/record/186136/abstract
[2] Clinical data buoys protein degradation field. Retrieved May 31, 2020, from https://cen.acs.org/pharmaceuticals/oncology/Clinical-data-bouys-protein-degradation/98/web/2020/05
[3] ARV‐110 Phase ½, Dose Escalation: Interim Update. Retrieved May 31, 2020, from https://ir.arvinas.com/static-files/53b045f7-b4a3-4344-b995-912fc7169b62
[4] Arvinas Releases Updated Dose Escalation Data from Clinical Trial of PROTAC® Protein Degrader ARV-110 in Patients with Metastatic Castration-Resistant Prostate Cancer. Retrieved May 31, 2020, from https://ir.arvinas.com/news-releases/news-release-details/arvinas-releases-updated-dose-escalation-data-clinical-trial
[5] CC-92480 Shows Encouraging Efficacy in First-in-Human Study for R/R Multiple Myeloma. Retrieved May 31, 2020, from https://www.onclive.com/conference-coverage/asco-2020/cc92480-shows-encouraging-efficacy-in-firstinhuman-study-for-rr-multiple-myeloma
[6] Hansen et al., (2020). Discovery of CRBN E3 Ligase Modulator CC-92480 for the Treatment of Relapsed and Refractory Multiple Myeloma. J. Med. Chem, https://doi.org/10.1021/acs.jmedchem.9b01928
协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于召开第七届七次理事会暨会长办公会
各相关单位: 经研究,四川省医..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..认真落实巡视组反馈意见,进一步规范协
按照四川省市场监督管理局党组巡视..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于召开会长办公会的通知
各会长、副会长单位: 根据四川..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..