今日,Zydus Cadila公司宣布,印度药物管理局(DCGI)已批准其PPARα/γ双重激动剂saroglitazar magnesium上市,治疗非肝硬化性非酒精性脂肪性肝炎(NASH)患者。新闻稿指出, saroglitazar magnesium是世界上第一款获批治疗非肝硬化性NASH的药物。

NASH是一种严重的非酒精性脂肪性肝病(NAFLD),是指酒精以外其它因素导致的肝细胞内脂肪过度沉积的病理综合征。据新闻稿中的统计信息,在全球范围内,已有10%-30%的人口受到该疾病影响。NASH会导致肝细胞发生炎症和退化。NASH的进展会引起肝纤维化,肝硬化和肝功能衰竭的发生,也有可能诱发肝癌。作为代谢性炎症的一种,NASH的产生与肥胖,糖尿病和血脂代谢异常等因素密切相关。目前,治疗手段仍然相对匮乏。
Saroglitazar magnesium是一种新型的过氧化物酶体增殖物活化受体(PPAR)激动剂,它同时具有调节PPARα和PPARγ活性的功能。PPARα/γ是调控机体新陈代谢方面的重要转录因子,在脂肪代谢和胰岛素抗性方面都有重要作用。此前的非临床数据表明,与单纯的PPARα或PPARγ激动剂相比,saroglitazar magnesium独特的双重作用机制对疾病的治疗效果更加显著。该药物于2013年9月在印度获批上市,治疗非他汀类药物无法控制的2型糖尿病患者的糖尿病血脂异常和高甘油三酯血症。今年1月,该药物获得了治疗2型糖尿病患者的批准。在过去的七年中,超过一百万患者受益于这种药物。
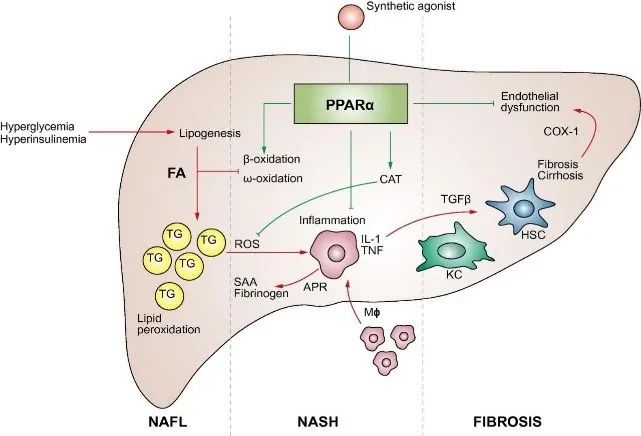
▲PPARα在NAFLD疾病发展不同阶段的作用(图片来源:参考资料[3])
此前,该药物曾在美国进行的一项2期临床研究中接受检验,该研究名为EVIDENCES IV,是一项随机,双盲,含安慰剂对照组的研究,共有106名患者参与。该试验的主要研究终点是在第16周时,与安慰剂组相比,接受saroglitazar magnesium治疗患者的肝脏丙氨酸转氨酶(ALT)水平较基线时的变化。试验的次要终点包括通过无创核磁共振质子密度脂肪分数(MRI-PDFF)测量的肝脂肪含量变化等多项指标。试验结果表明,与安慰剂组相比,saroglitazar magnesium使患者的ALT水平下降了44.39%。此外,通过MRI-PDFF定量评估患者的肝脂肪含量也达到了统计学意义上的显著降低。
“我们很高兴可以为NASH患者开发一种新型药物,满足这一高度未满足的医疗需求,“Zydus公司董事长Pankaj Patel先生说:”Saroglitazar magnesium将为数百万名NASH患者提供新的希望。“
四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..认真落实巡视组反馈意见,进一步规范协
按照四川省市场监督管理局党组巡视..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于召开会长办公会的通知
各会长、副会长单位: 根据四川..四川省医药保化品质量管理协会组织召开
2025版《中国药典》将于2025年10月..四川省医药保化品质量管理协会召开第七
四川省医药保化品质量管理协会第七..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..