今日,Horizon Therapeutics宣布美国FDA已批准其创新疗法Tepezza(teprotumumab-trbw)上市,用于甲状腺眼病(thyroid eye disease ,TED)的治疗。值得一提的是,这是这一罕见眼病的首款获批疗法!而且,这一获批比预计的日期提早了一个多月!
TED是一种威胁视力的罕见进行性严重自身免疫性疾病。患者的症状包括眼球突出、复视、视力模糊、疼痛和面部畸形等,可能严重影响患者的生活质量。这是一种经常发生在甲亢患者身上的独特疾病,病因是由于自身抗体激活了眼眶内细胞中胰岛素样生长因子1受体(IGF-1R)介导的信号复合体。这种疾病分为几个不同的阶段,其中活跃期大约持续2-3年,缺乏有效的治疗手段。而在疾病进入稳定期后,才能接受眼科手术进行治疗。
针对病因,Horizon Therapeutics开发的teprotumumab能结合IGF-1R,阻断其介导的信号通路。在两项临床试验中,该疗法展现出了良好的治疗效果——治疗的24周后,接受teprotumumab治疗的患者中,82.9%的患者眼球突出有明显改善,安慰剂组这一数值为9.5%。同时,teprotumumab达到所有次要终点,包括减少复视,生活质量改善等。基于这些结果,FDA曾授予它突破性疗法认定、孤儿药资格、快速通道资格、和优先审评资格。原定该药物的答复日期为3月8日。今日的获批,则比预期提早了1个多月!
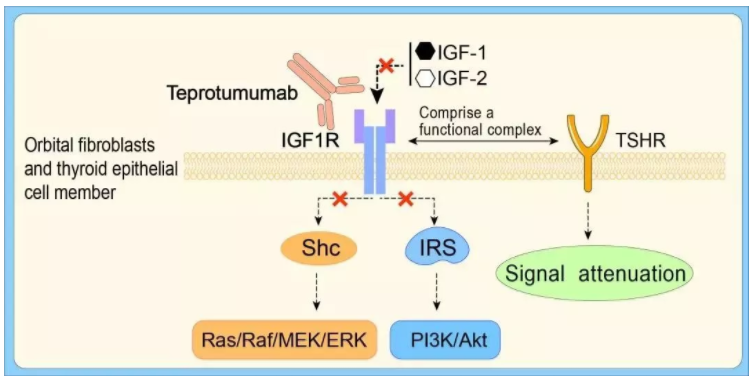
▲Teprotumumab的作用机制(图片来源:参考资料[3])
美国FDA药物评估和研究中心的Wiley Chambers博士评价说:“今日的获批标志着甲状腺眼病治疗的一个重要里程碑。目前,对于这种潜在使人衰弱的疾病,治疗方案非常有限。本次批准的疗法有望改变疾病的进程,让患者无需多次接受具有侵入性的手术。”
Chambers博士也指出,甲状腺眼病是一种非常罕见的疾病。今日的获批,也标志着FDA对罕见病治疗的持续关注。
参考资料:
[1] FDA approves first treatment for thyroid eye disease, Retrieved January 21, 2020, from https://www.fda.gov/news-events/press-announcements/fda-approves-first-treatment-thyroid-eye-disease
[2] FDA Approves TEPEZZA (teprotumumab-trbw) for the Treatment of Thyroid Eye Disease (TED), Retrieved January 21, 2020, from https://www.businesswire.com/news/home/20200121006017/en/FDA-Approves-TEPEZZATM-teprotumumab-trbw-Treatment-Thyroid-Eye
[3] Teprotumumab Overview. Retrieved Feb. 28, 2019, from https://www.creativebiolabs.net/teprotumumab-overview.htm
来源:药明康德
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..