营销能力的表现是市场的实现能力,是获得现金流生存的能力;
而研发能力则是技术的实现能力的体现,是未来能持续获得现金流的能力。
当然,还有人说:资本运作能力、财务处理能力等等都是核心竞争力,这些能力也都非常重要,但权重很多时都不如前两个能力。

制药企业的核心竞争力权重分析表
营销能力毋庸置疑是最重要的。没有强大的营销实现能力,再好的产品也是在深闺之中无人问津,不能带来实际的销售和利润,也仅仅是纸上谈兵pipeline竞争。
不仅创新药企业需要研发能力,仿制药企业也同样需要研发能力。尤其是仿制药企业,对研发能力更需要重视。
在快速竞争时代,能选择好产品,并能实现产品的快速上市,在竞争中领先一步,是参与市场博弈的首要条件。因此仿制药企业的快速抢仿能力非常关键。
纵观中国近20年的医药发展史,那些成长稳健未来可期的企业,无一例外都是两个核心能力都布局非常不错的企业,例如恒瑞、天晴、豪森、海思科、科伦、石药、倍特等。
在分析新形势下的药企研发核心竞争力之前,首先是对于外部环境的变化总结。
01
游戏规则的巨大改变
4+7带来的影响是巨大的,使得中国医药市场的竞争规则发生了巨大改变。规则的改变有以下四点:
专利悬崖出现,价格迅速下降到谷底取代以前的小步下滑。不仅仅是原研药在专利到期之后会出现,仿制药的价格也随之同步下降,甚至有的专利没有到期的产品,由于同类竞争品的存在,原研厂家出于与国家医保谈判的需要,主动大幅下降产品价格。
剂型归一,4+7集采合并集采谈价,未来医保局可能在此基础上全国统标。例如以口服常释剂和注射剂取代了以往依照剂型的精细化分组,杜绝了中国式改剂型规避竞价的漏洞,那些改剂型产品,将没有价格空间和操作空间。
产品生命周期缩短。4+7后的仿制药产品生命周期在专利到期后将下降至5年左右。以前的中国仿制药企一个仿制药成功吃个10、20年的日子将一去不复返。产品的生命周期缩短,意味着同样的时间周期内,仿制药企业必须提供更多的上市产品进行销售,对药企的研发效率和研发速度提出了挑战。
利润率回归制造业。医药行业在近十年一直以高利润率自称,制药行业的平均利润率高达5%,百强领先企业的利润率更是平均在10%左右。而中国制造业整体企业平均税后利润率3.3%。4+7后,随着药品价格的回归,高利润被打压,医药行业的利润率也将回归制造业。
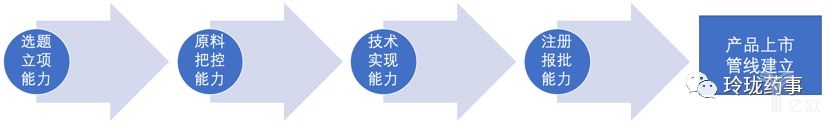
在药企的研发核心竞争力,有4个方面:
选题立项能力,原料把控能力,技术实现能力,注册报批能力。
02
选题立项能力
选题立项能力一直是研发能力的基石。方向是最重要的,方向错了,技术越完美,给公司带来的损失也越大。
这种损失直接体现在财务成本上较少,更严重的是机会成本、时间成本的损失。
创新药企业需要强大的选题立项能力,仿制药企业更需要。
前述分析已经谈过,未来市场的竞争机会稍纵即逝,时间窗有限,但同样的研发周期内却需要提供更多的产品上市应对市场竞争,而对于市场的预测和判断是基于现在的治疗状况、医疗态度和历史数据及信息来判断的。
实际上,很多本土企业缺乏的是当原研没有在国内上市并成功时,如何选题如何判断。很多仿制药企业以前的研发选题立项大都是研发人员兼任,研发人员的优势是对技术熟悉,但技术仅是实现产品的手段,不是实现产品的目的。
而如何在市场和临床中实现产品是技术人员所缺乏的知识体系,这个知识体系的建立不仅需要建立理论体系,更需要大量的实践和经验。因此,选题立项人员也需要专业化,经验和知识的积累尤为重要。
不管任何时候,医药品选题立项都需要同时满足两个需求:临床需求和市场需求。
第一、临床需求是根本。不能满足明确临床需求的医药品,那不是医药品,是保健品。对于患者和医生而言:药品最本质的价值是有效性和安全性,研发选题应该以疾病为核心做到以终为始。
没有临床需求的选题立项标准,就会一头扎进辅助用药的大海,看不清方向。
第二、光有临床需求,不对市场进行预判,没有有效的市场需求,也是在浪费公司的资金和时间。
譬如罕见病市场,有很多罕见病中国的患者非常有限,即使将来解决了医保支付问题,实际的市场也将很有限。如果不是可以以罕见病为跳板拓展到其他疾病领域,项目的价值其实不高。
研发的资金成本和机会成本高企的今天,选这样的项目需要三思,除非是为了寻求政府资助或者企业有公益的考量。
有的疾病领域,看起来患者多,但实际上获取成本、替换成本高昂,市场的吸引力也将下降。
有的疾病领域,已有先行者耕耘多年,拥有雄厚的品牌影响力,且在可见时间之内公司的战略不会发生重大改变,新进入者是否要进入这样的领域拼杀,也是需要权衡。因此,对于竞争和赢获能力的分析将是选题立项过程中不可或缺的一环。
选题立项能力是研发核心能力的基石,也是集体智慧的结晶。4+7之后研发成本高企,药企将更重视选题立项,以期在立项阶段就开始提高研发成功率。
03
原料把控能力
没有原料API就没有最终的制剂产品。
但4+7让药企对原料的重视提高到了前所未有的高度。
南京天晴虽然首家通过瑞舒伐他汀一致性评价,但在126大战中惜败于浙江京新,让业界侧目扼腕,就是原料药受制于人的最惨痛教训(与先声东元一样,南京天晴瑞舒伐他汀原料来自于浙江京新)。
而浙江京新,拥有国内一线他汀最全的产品线,是全球他汀大王,在4+7大战中获得胜利也就不令人意外了。实际上,浙江京新认为,真正跟京新形成竞争的,也就是原研阿斯利康和鲁南贝特(均为原料+制剂一体)。
南京天晴如果能及早意识到京新的战略和对竞争对手的分析判断,有应对方案,那么也许今天的结果会完全不一样。
很多慢性病治疗药,用量高市场大价格低,价格敏感,原料的价格更是分毫必争,对于原料的控制要求就更高,如果自己没有原料或者对原料不能有效把控,在未来的4+7竞争中,基本上是没有竞争能力的。
在今年化工工厂接连几项事故后,对于原料药企业要求更加苛刻,环保要求会越来越高,原料的供给在未来将会更受制于人,因此国内企业可能需要寻求更广泛的原料合作,放眼全球,争取提高把控原料的能力。
原料、辅料的解决、合作与把控能力在很多产品上会是决定性的因素之一。工艺路线的不断优化、成本的不断降低,规模化的企业更有优势,中小型仿制药企业需要权衡在规模化难以企及超大企业的情况下,如何进行原料的把控和布局。
04
技术实现能力
重视研发的药企,都会重视技术实现能力。
不管是自主研发还是委托研发、合作开发,只要能以合理的成本在限定的时间内做出来产品,都是技术实现能力的体现。企业要明确的是:最终产品上市的时间和成本,根据需要选择合适的技术手段实现这一目的。
1557840579482727.jpeg
技术实现能力通路及控制要点
自主研发,研发领军人物非常关键。同时,还需要完善的研发体系,精干专业的研发团队,强悍的基础研究和应用研究能力,还要有足够的经验。
委托研发,由于新药研发成本不断增加,一些有技术难度的项目,以及对研发时效的要求,很多公司采取了研发外包战略,把非核心开发业务或部分高难项目委托交给更专业或有经验的CRO企业。
合作开发也是实现技术的手段。实际上,很多现在研发能力领先的企业,都是合作开发起步逐步学习建立自己的研发核心竞争力。例如天晴、恒瑞等,在很多年前研发能力还比较薄弱的时候,有不少项目都是合作开发。
一方面,可以充分利用双方的优势,进行优势资源的整合利用,降低整体研发成本,另一方面,也分散了研发的风险,同时在项目进行过程中,也能培养企业自己的研发能力,确保技巧不丢失。
合作开发的能力要求有:广泛的合作公司储备,良好的对合作公司的项目管理能力,以及卓越的对合作方选择和评估能力。
直接购买项目。这是BD工作中很重要的一项工作。购买的项目不仅考虑企业的战略眼光,也同样考虑企业的落地能力。实际上,有很多产品在落地环节上不是一帆风顺的,有很多技术的问题在一开始的时候难以预料。
总而言之,技术实现的路径多种多样,但技术实现能力的培养是要持续连贯的,如果选择的方式过多,说不定哪个能力都仅仅是浅尝则止,难以建立更有竞争力的核心能力。因此,到底如何进行技术实现能力的组合也是需要认真考量的。
05
注册报批能力
在选好项目,确定了技术实现手段,解决了原料问题,最后自然就是注册报批能力。
注册报批能力是技术产品获得市场准入的第一道关口。
注册报批能力的直接体现就是报批时间更短和报批成本更低。
注册报批能力方面,可以分为:法规政策的解读和预判能力,注册策略的建立能力,注册资料的撰写能力,人脉资源及沟通能力。

注册报批能力通路及控制要点
不仅仅包括对药品注册法规的理解、分析和解读能力,同时能对政策法规预判;除了有对项目的整体理解和评价,还要有良好的注册资料撰写能力;具有良好的人脉关系,准确把握与CDE审评专业人员的沟通和交流;此外,具有高超的注册策略建立能力。
实际上,对于政策法规、指导原则的解读能力,大多数企业还是相对薄弱的。能对法规原则解读到位的厂家还是很有限的,能在申报中踏对了节奏的厂家更是少之又少。
同样的产品申报,有的可以快速上市,有的还在排队等待。例如在722刚开始的时候,有的厂家把申报的产品撤回后,做BE以新4类申报上市,不仅可以获得优先审评资格(撤回产品),而且新的BE结果可以以“视同通过一致性评价”,弯道超车快速获得批准,让竞争对手望洋兴叹。
在对法规原则的解读和预判的基础上,根据不同的产品确立公司不同的注册报批策略,同时还要对竞争对手的申报策略进行分析。良好的注册报批策略可以节省研发的很多时间,少走很多弯路。
例如有的产品免临床申报比没有免临床的会快很多,只做了验证性临床的,比批大临床的要节省很多费用和时间。同样的项目研发,别的企业2年申报注册成功,自己的企业能减少发补次数,节省个一年半载,就是胜利。
国内有很多新兴研发企业在注册报批方面做的相当不错。还有那些抢仿总是能走在前端的领先企业,他们的注册申报策略非常值得研究和学习。
现在很多企业在寻求中美双报,对企业的注册报批能力提出了更高的要求,因此,与外部合作成为了很多企业快速申报上市的方法。
4+7之后,注册报批能力是决胜仿制药企业产品迅速上市的关键因素之一。
06
结语
总而言之,4+7后,仿制药药企的研发竞争能力的改变如下:
选题立项能力更加重视,更关注产品的整体成功率。将需要考虑同时满足临床需求和市场需求,更加强调博和专的专业能力。良好的BD经理,不仅是研发的项目经理,还是产品的产品经理。不仅关注产品的技术实现,还需要考虑产品的市场实现。
原料把控能力更得到重视,在同质化的竞争中将起到举足轻重的作用。
技术实现能力的重视一如既往,但将更强调合作管理和技术升级。
注册报批能力更强调对政策法规、指导原则的解读能力,根据不同的产品建立合适的报批策略,研究竞争对手的申报策略,真正缩短公司报批时间,注册报批能力也是决胜仿制药企业产品迅速上市的关键因素之一。
总而言之,企业的研发核心竞争力内涵将更加丰富,更强调速度,更能应对未来多变的激烈竞争。
来源:玲珑药事 作者:玲珑姐
协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于召开第七届七次理事会暨会长办公会
各相关单位: 经研究,四川省医..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..认真落实巡视组反馈意见,进一步规范协
按照四川省市场监督管理局党组巡视..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于召开会长办公会的通知
各会长、副会长单位: 根据四川..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..