新药上市申请新状态
本周,国内新药上市申请有7项6款药品有新的动态。其中有2款中药5类新药,1款化药1类新药、化药2.1类新药、治疗用生物制品1类新药、治疗用生物制品15类新药。 3月28日,总局承办了由北京华昊中天生物技术全资子公司成都华昊中天药业有限公司申请的化药1类新药优替德隆(UTD1)、优替德隆注射液的上市申请。优替德隆(UTD1)是一种基因工程埃博霉素类似物,也是是一类新型的非紫杉类抗微管蛋白聚合类抗肿瘤药物。在Ⅰ期和Ⅱ期临床研究中,显示出了对乳腺癌的治疗潜力。据称,此药Ⅲ期临床结果曾发布于国际著名肿瘤学期刋《Lancet Oncology》。研究结果表明,对既住经多程治疗后进展的乳腺癌患者,优替德隆联合卡培他滨方案疗效显著,为晚期乳腺癌患者提供了新的有效治疗方案,该方案能够明显延长患者的PFS,并有改善OS的明显趋势。 3月28日,总局承办了南京圣和的左奥硝唑片2.1类新药上市申请,左奥硝唑是南京圣和一个重要的明星产品,此前南京圣和还申请了左奥硝唑片1.3类新药的申请。目前湖南华纳大药厂有限公司的新药1.3类左奥硝唑片已经批准上市。 3月28日,总局承办了山东药学科学院申请的两款中药5类新药的上市申请,分别为侧金盏口腔溃疡贴片 、黄蜀葵花总黄酮提取物。侧金盏口腔溃疡贴片是从中药侧金盏中采用先进的提取、分离、纯化技术,得到有效部位总黄酮制成的制剂,具有清利湿热,消炎解毒之功效,用于各种因素引起的口腔溃疡。黄蜀葵花总黄酮提取物是黄蜀葵花有效部位,现代药理学研究已证明黄酮类成分具有止痛和治疗心脑血管方面疾病的作用。具体说,黄蜀葵花黄酮类化合物具有镇痛消炎;抗脂质过氧化、减少自由基生成、抑制细胞凋亡,保护心脑缺血性损伤;体外抗单纯疱疹病毒等作用。 3月28日,博雅生物人凝血因子Ⅷ上市申请获承办,人凝血因子Ⅷ为人血液制品,主要用于防治甲型血友病和获得性凝血因子Ⅷ缺乏而致的出血症状及这类病人的手术出血治疗。此前国内还有上海生物制品研究所、山东泰邦生物制品有限公司、上海新兴医药股份有限公司、同路生物制药股份有限公司的新药已经批准上市。国内市场主要销售企业如下所示,华兰生物位居首位,多年来共计销售额为8.29亿元,2017年销售额为1.99亿元。 本周有19个(以受理号计)药品临床申请有新的动态。 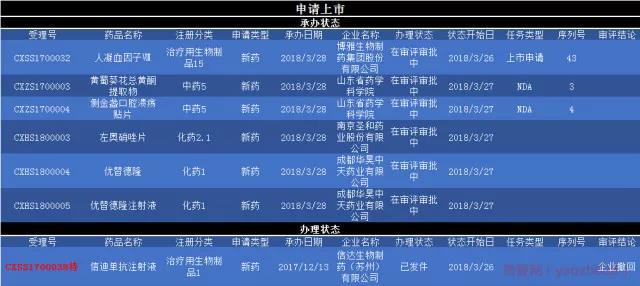
★首个申请上市的国产PD-1单抗被企业撤回
由信达生物2017年12月申报的特殊审批品种信迪单抗注射液上市申请在3月26日显示新的状态,目前审评结论是企业撤回,具体原因有待考究。信迪单抗注射液代号IBI308,申请适应症为霍奇金淋巴瘤。除此适应症之外,IBI308还进行了非小细胞肺癌 、食管癌以及NK/T细胞淋巴瘤临床研究,主要用于治疗晚期实体瘤。信迪单抗注射液是首个申请上市的国产PD-1单抗。也是继百时美施贵宝Opdivo之后第2个申请中国上市的PD-1/PD-L1药物,一度受到业界广泛关注。
★Ⅲ期结果曾登Top3肿瘤学期刊的1类新药申请上市
★南京圣和2.1类新药申请上市
★山东药学科学院两款中药5类新药申请上市
★博雅生物制药人凝血因子Ⅷ申请上市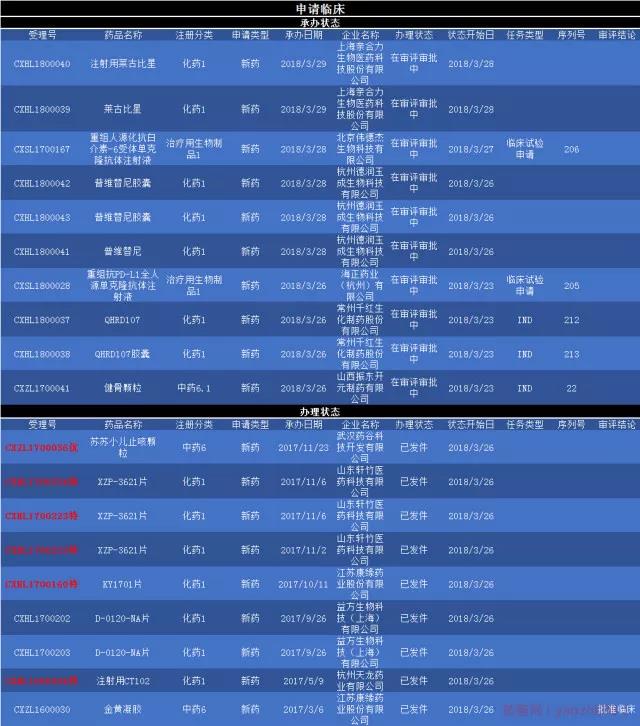
新药临床申请新状态

3款化药1类新药临床申请被承办,分别为上海亲合力生物医药科技股份有限公司的莱古比星、杭州德润玉成生物科技有限公司的普维替尼、常州千红生化制药股份有限公司的的HRD107。
2款治疗用生物制品1类新药被承办,分别为北京伟德杰生物科技有限公司的重组人源化抗白介素-6受体单克隆抗体注射液,海正药业(杭州)有限公司的重组抗PD-L1全人源单克隆抗体注射液。 1款中药6.1类新药临床申请被承办,为山西振东开元制药有限公司的健骨颗粒。 另外,有2款中药6类新药,4款化药1类新药受理有更新,显示已发批件。为武汉药谷科技开发有限公司的苏苏小儿止咳颗粒,此药为优先审评药品;另外江苏康缘的金黄凝胶获得临床批件;还有山东轩竹、江苏康缘、杭州天龙的特殊审批药品,XZP-3621片、KY1701片、注射用CT102,益方生物科技的D-0120-NA。
认真落实巡视组反馈意见,进一步规范协
按照四川省市场监督管理局党组巡视..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于召开会长办公会的通知
各会长、副会长单位: 根据四川..四川省医药保化品质量管理协会组织召开
2025版《中国药典》将于2025年10月..四川省医药保化品质量管理协会召开第七
四川省医药保化品质量管理协会第七..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..学习传达中央八项规定精神专题会议
2025年4月22日,协会党支部组织召..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..