编辑说:国家十三五规划提出了“健康中国”的目标,而于今年8月11日分布的《中医药发展“十三五”规划》,都显示出国家大力发展中医药文化,推动中医药走向世界,中药现代化、国际化已成为不可阻挡的趋势。与此同时,随着人们健康意识的日益提高,重要临床疗效和安全性成为社会普遍关注的问题。中药上市后再评价是大趋势,也是涉足中医药领域的企业高度重视的问题。

中国中医科学院中医临床基础医学研究所常务副所长 谢雁鸣
中药上市后再评价研究在我国取得初步成果
在第28届全国医药经济信息发布会上,中国中医科学院中医临床基础医学研究所常务副所长谢雁鸣为我们详细解读了《中成药上市后再评价与临床合理用药》, “中药上市后再评价真正开展起来不过10余年时间,但已有较大发展,影响日益深远。”谢雁鸣指出,中药上市后再评价研究越来越受到制药企业的重视,已经逐步开展。
中药上市后再评价的相关法规从最初的简单规定,到后来对内容和方法的规范,并与医保、基药、中保目录的遴选以及药物再注册制度相衔接,是一个从认识上逐步具体和深入的过程。
谢雁鸣教授说,在古代,中药药效、不良反应评价以《本经》为代表。时至今日,各地中药注射剂安全性再评价及风险评估工作方案陆续出台:
2001年12月《中华人民共和国药品管理法》第三十三条规定开展上市后再价;2009年1月关于开展中药注射剂安全性再评价工作的通知及工作方案,《中药注射剂安全性再评价生产工艺评价技术原则(试行)》等7个技术原则,以规范和指导中药注射剂安全性再评价工作。
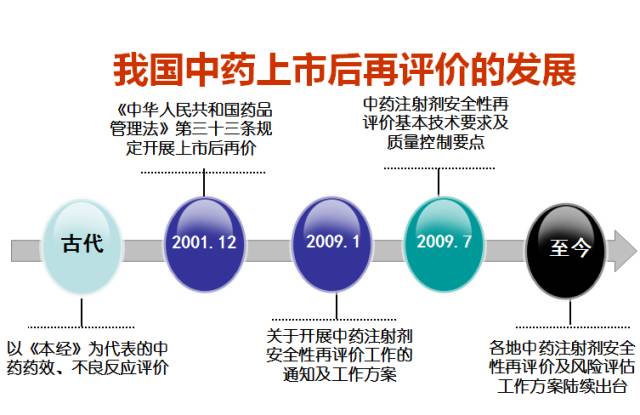
我国中药上市后再评价的发展
政策利好推动独家中药增加再评价研究的投入
2016年2月14日,国务院召开常务会议,部署推动医药产业创新升级,会议确定加大中医药投入和政策扶持,在国家基本药物目录中增加中成药品种数量。
谢雁鸣指出,我国基本药物目录遴选是根据《国家基本药物目录管理办法》(2009)要求,其中,咨询专家组根据循证医学、药物经济学对纳入遴选范围的药品进行技术评价,提出遴选意见,形成备选目录。我国医保目录遴选是根据《城镇职工基本医疗保险用药范围管理暂行办法》(1999),其中提到,在全国范围内选择专业技术水平较高的临床医学和药学专家,组成药品遴选专家组,负责遴选药品。
对于我国中药保护品种申报,在《中药保护品种指导原则》(2009)要求指出,申报资料要有上市后的研究资料,包括不良反应监测情况及质量标准执行情况等相关资料。应开展以广泛应用的安全性评价为目的的临床研究,二级甲等医院可参加研究。在安全性评价中,应注重常规安全性观察,如三大常规检查、肝肾功能、心电图检查等,以及与品种自身特点和主治适应症有关的特殊安全性观察,如含有配伍禁忌品种、前期研究提示有特殊毒性品种、注射剂等。

我国中药保护品种申报
以龙心®芪龙胶囊为例,其组方源于补阳还伍汤,采用清华大学专利技术,由中国中医科学院进行临床研究;其作为国家重点新产品、独家产品,并有清华专利,享受国家行政保护,在临床应用超过十年,效果追踪,疗效显著。谢雁鸣表示,该药在上市后进行了二次开发,从药学、药理、临床进行相关研究,并构建大品种培育路径,充分挖掘产品的特色与潜力,在医保政策、招标政策、新药政策等方面都做了相关的提升。
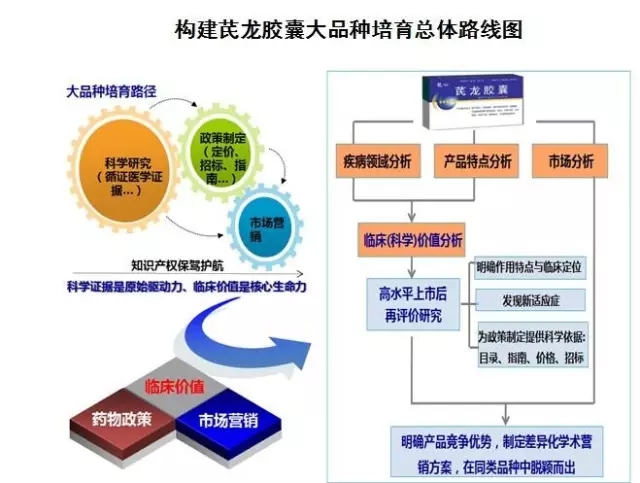
构建芪龙胶囊大品种培育总体路线图
中药上市后再评价是以需求为驱动,是逐步深入的过程,也是相关法规逐渐健全的过程。随着中药上市后再评价研究的发展,其影响力将进一步增强,必将深入我国的医药卫生体系,提供科学客观的证据,发挥更加重要的作用。(米内网 单文贤报道)
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..