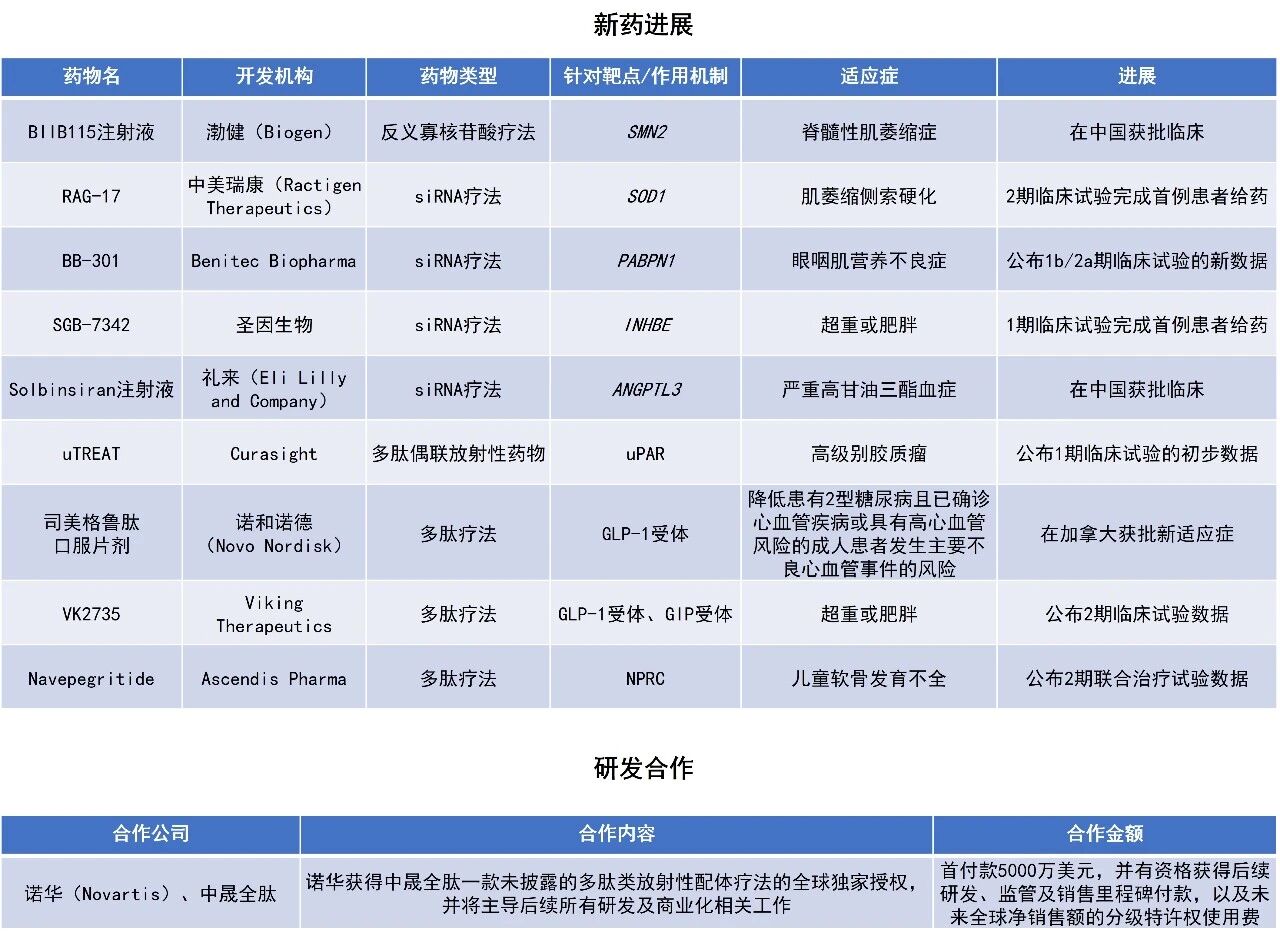
近期,全球多肽和寡核苷酸(TIDES)领域迎来系列进展。诺和诺德(Novo Nordisk)宣布其司美格鲁肽口服片剂在加拿大获批新适应症,用于降低2型糖尿病患者发生心血管事件的风险。礼来(Eli Lilly and Company)降血脂新药solbinsiran注射液在中国获批临床。本文将节选其中部分重要进展做简单介绍,仅供读者参阅。
司美格鲁肽:在加拿大获批新适应症
诺和诺德宣布,加拿大卫生部已批准司美格鲁肽口服片剂(商品名:Rybelsus)用于降低患有2型糖尿病且已确诊心血管疾病或具有高心血管风险的成人患者发生主要不良心血管事件(MACE,包括心血管死亡、非致死性心肌梗死或非致死性卒中)的风险。Rybelsus是加拿大首个获批的口服胰高血糖素样肽-1(GLP-1)受体激动剂,最初于2020年4月获批用于在饮食和锻炼的基础上改善2型糖尿病患者的血糖控制,此次新增适应症使其成为兼具降糖与心血管保护作用的口服GLP-1疗法。
该新适应症基于临床试验SOUL的结果。SOUL是一项随机、双盲、平行组别、安慰剂对照、事件驱动的3期研究,共纳入9650名患有2型糖尿病并伴动脉粥样硬化性心血管疾病(ASCVD)和/或慢性肾病(CKD)的成人。研究达到主要终点,Rybelsus使患者发生MACE的风险降低14%(3年时绝对风险降低2%)。Rybelsus与安慰剂组患者发生MACE的事件数分别为579例与668例;风险比(HR)为0.86(95% CI:0.77–0.96,P=0.0055)。主要终点定义为,从患者随机化起首次发生主要不良心血管事件的时间,包括心血管死亡、非致死性心肌梗死或非致死性卒中。
Solbinsiran注射液:在中国获批临床
中国国家药监局药品审评中心(CDE)官网最新公示,礼来申报的1类新药solbinsiran注射液获批临床,拟开发作为饮食控制的辅助疗法,用于成人严重高甘油三酯血症的治疗。Solbinsiran是一种与N-乙酰半乳糖胺(GalNAc)偶联的小干扰RNA(siRNA),旨在抑制血管生成素样蛋白3(ANGPTL3)mRNA在肝脏中的生成,GalNAc可以增强siRNA分子的肝脏特异性递送。研究表明,较低的ANGPTL3活性与较低的甘油三酯水平及较低的心血管风险相关。
在全球范围内,solbinsiran注射液正在针对混合性高脂血症、高甘油三酯血症展开2期临床研究。此前,礼来公布了solbinsiran注射液用于成人混合性血脂异常的2期临床研究结果。治疗第180天时,400 mg solbinsiran可将载脂蛋白B降低14.3%,同时其他5个脂质相关指标——甘油三酯、低密度脂蛋白胆固醇(LDL-C)、非高密度脂蛋白胆固醇(HDL-C)、极低LDL-C和HDL-C水平分别降低50.3%、16.8%、25.5%、50.1%和16.4%,患者整体耐受性良好。
VK2735:公布2期临床试验数据
Viking Therapeutics公司宣布,其在研多肽疗法VK2735用于治疗肥胖的2期临床试验VENTURE的结果已在《肥胖》(Obesity)期刊上发表。该药物是一种葡萄糖依赖性促胰岛素多肽(GIP)和GLP-1受体双重激动剂,目前正以口服和皮下注射两种剂型开发,用于治疗包括肥胖在内的多种代谢性疾病。
该临床试验的结果显示,在接受13周每周一次VK2735皮下给药后,不同剂量组患者的平均体重降幅最高达14.7%(14.6 kg),且未出现疗效平台期,达到了试验的主要和次要终点。93%(130/140)的VK2735治疗患者实现≥5%的体重下降,而安慰剂组仅为12%(4/34)。安全性方面,VK2735总体耐受良好,大多数不良事件为轻度或中度。与安慰剂组相比,治疗组的停药率和研究退出率相当。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..