1 月 16 日,CDE 官网显示,武田在国内递交了 1 类新药奥博雷通片的上市申请。根据武田的公开资料,Insight 数据库推测该药为武田开发的食欲素受体 2 (OX2R) 激动剂 Oveporexton(TAK-861),本次申报的适应症可能为 1 型发作性睡病。2024 年 9 月,Oveporexton 的该适应症已被 CDE 纳入突破性治疗品种。
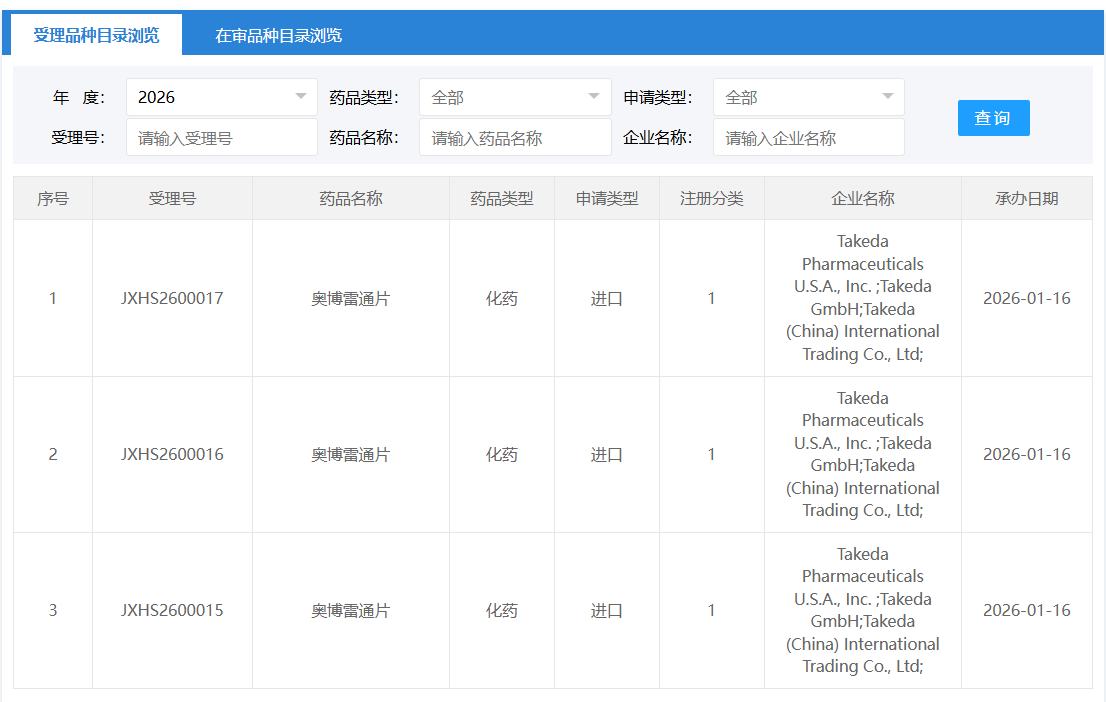
截图来源:CDE 官网
发作性睡病是一种慢性、罕见的中枢性嗜睡症神经系统疾病,尽管有多种疗法获得批准,但仍存在大量未满足的需求。它目前分为两种不同类型:1 型发作性睡病 (NT1) 和 2 型发作性睡病 (NT2)。其中,1 型发作性睡病是由于食欲素神经元丧失所致,患者的症状包括白天过度嗜睡、猝倒、夜间睡眠中断、入睡前/入睡后幻觉、睡眠麻痹等。
Oveporexton 是一款 OX2R 激动剂。Ox2R 激动剂可通过恢复内源性食欲素水平下降时丢失的下游神经递质活性,从而帮助 1 型发作性睡病患者恢复食欲素信号传导。
2025 年 7 月,武田宣布,Oveporexton 治疗 1 型发作性睡病的两项关键 III 期 临床 FirstLight (TAK-861-3001)和 RadiantLight (TAK-861-3002)研究均达到所有主要和次要终点。
数据显示:与安慰剂相比,在第 12 周时,Oveporexton 所有剂量组主要和次要终点均有显著改善,p 值均小于 0.001。主要和次要终点包括警觉性、日间过度嗜睡、猝倒、持续注意力、整体生活质量和日常功能等客观和主观指标,所有指标均显示出接近正常范围的、具有统计学意义且具有临床意义的改善。
安全性方面,Oveporexton 总体耐受性良好,其安全性与迄今临床研究中的表现一致。未报告与治疗相关的严重不良事件。最常见的不良事件为失眠、尿急和尿频。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..