据 Insight 数据库统计,2025 年以来,恒瑞共有 9 款 1 类新药首次启动 III 期临床,开始向上市申请发起冲刺。
从药物类型来看,包括 6 款化药和 3 款生物制品;从疾病领域来看,包括肿瘤、哮喘、慢性肾脏病、心血管等疾病领域新药。
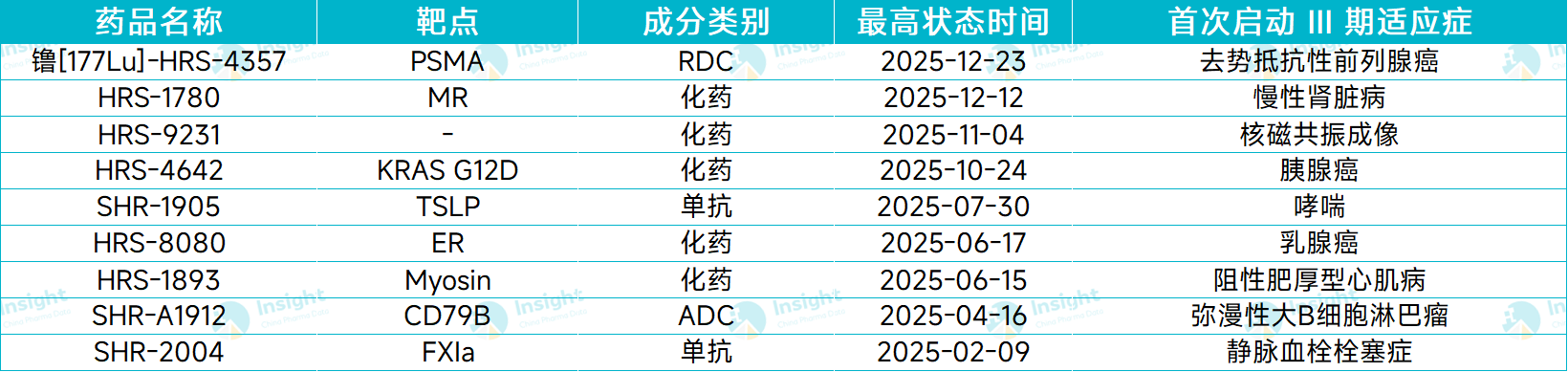
图片来源:Insight 数据库整理
HRS-4357
12 月 23 日,恒瑞在国内启动了一项随机、开放、对照、多中心 III 期临床研究,旨在对比 HRS-4357 和新型雄激素受体通路抑制剂用于 PSMA 阳性的进展性转移性去势抵抗性前列腺癌(mCRPC)治疗的安全性和疗效。
该试验拟在国内入组 370 人,研究的主要终点是由 BIRC 评估的 rPFS。
HRS-4357 为恒瑞医药自主研发的化学药品 1 类放射性治疗类创新药。到目前为止,该药已经在国内获批多项适应症临床试验:
适用于既往接受过雄激素受体(AR)通路抑制剂和紫杉烷类化疗的 PSMA 阳性的 mCRPC 成人患者;
联合基于 ADT 和 ARPI 的标准治疗用于治疗 PSMA 阳性的前列腺癌成人患者;
联合 HRS-5041(AR PROTAC)用于治疗 PSMA 阳性的前列腺癌成人患者。
HRS-1780
12 月 12 日,上海拓界宣布 HRS-1780 进入 III 期临床试验,这是一项在成人慢性肾脏病参与者中评价 HRS-1780 的有效性和安全性的多中心、随机、双盲、安慰剂平行对照的 III 期研究。
上海拓界与恒瑞医药持续深化战略合作伙伴关系,除 HRS-1780 外,双方合作的 HRS-5346、HRS-6209、HRS-1301、HRS-9813、HRS-3802、HRS-6208、HRS-2183 等小分子新药项目亦已进入临床试验阶段。
HRS-1780 是一种高选择性非甾体类盐皮质激素受体(MR)拮抗剂,具有优异的受体亲和力与靶向选择性,通过高效抑制 MR 过度激活,发挥抗炎、抗纤维化作用,从而实现对心、肾器官的双重保护,有望在心血管-肾脏-代谢综合征(CKM)整体管理与「糖心肾」共治格局中扮演关键角色。
在 2025 年 11 月美国肾脏病学会肾脏周(ASN Kidney Week 2025)公布的 II 期临床研究结果显示,HRS-1780 在慢性肾脏病(CKD)患者中表现出显著疗效与可靠的安全性。结果显示:
治疗第 13 周时,与安慰剂组相比,10 mg 和 20 mg 剂量组患者的尿白蛋白肌酐比值(UACR)从基线的百分比变化校正值分别为 -29.9%(P=0.0112)和 -53.5%(P<0.0001);
24 小时尿蛋白定量从基线的百分比变化校正值分别为 -29.4%(P=0.0068)和 -47.3%(P<0.0001);
安全性方面,两组高钾血症发生率分别为 4.5% 和 15.6%,总体不良事件发生率分别为 65.9% 与 64.4%(安慰剂组为 55.6%),进一步支持其良好的安全性特征。
HRS-9231
11 月 4 日,恒瑞在国内启动一项多中心、随机、双盲、阳性对照、交叉对照 III 期临床试验,旨在评价 HRS-9231 用于身体部位(中枢神经系统除外)磁共振成像(MRI)的有效性与安全性。
11 月 17 日,恒瑞又针对该药启动了第二项 III 期临床,旨在评价 HRS-9231 用于中枢神经系统(CNS)MRI 的 有效性和安全性。
MRI 是一种高效的非入侵性成像方法,适合用于检测大脑、脊髓、肌肉和肝脏等软组织的病变。这种技术的优势在于其高分辨率、多视角和多参数成像能力。MRI 通过利用生物组织在外部磁场作用下产生的不同共振信号进行成像,其成像质量依赖于氢原子核在受到射频能量激发后返回基态的两种不同弛豫时间:纵向弛豫时间 (T1) 和横向弛豫时间 (T2)。然而,在某些情况下,MRI 的分辨率可能无法满足临床需求,这时候就需要通过使用造影剂来增强图像对比度。
HRS-9231 注射液是恒瑞医药自主研发的一款新型 MRI 造影剂,能显著改善组织对磁场的反应,进而提升 MRI 图像的对比度,使人体内部结构和异常情况的观察更为清晰,有望为患者提供新的治疗选择。
HRS-4642
10 月 24 日,恒瑞在国内启动一项随机、对照、双盲、多中心 III 期临床研究,旨在评价 HRS-4642 联合吉西他滨+白蛋白结合型紫杉醇(AG)方案对比安慰剂联合 AG 方案一线治疗携带 KRAS G12D 基因突变的晚期或转移性胰腺癌的有效性和安全性。
HRS-4642 是一种高选择性、长效、非共价 KRAS G12D 抑制剂。
在 2025 年 ESMO 大会上,恒瑞以口头报告的形式披露了一项该药的 Ib/II 期临床研究结果。截至 2025 年 4 月 10 日,该研究共纳入 31 例胰腺癌患者。30 例初治患者中,确认的 ORR 为 60%,DCR 为 93.3%。安全性方面,未发生导致治疗终止的治疗相关的不良事件。
研究结果表明,HRS-4642 联合 AG 方案在晚期 KRAS G12D 突变型胰腺导管腺癌(PDAC)中显示出令人鼓舞的抗肿瘤活性和可控的安全性。长期疗效和安全性数据的随访正在进行中。
Insight 数据库显示,目前全球范围内共有超 30 款 KRAS G12D 抑制剂进入临床阶段,其中恒瑞的 HRS-4642 和劲方医药的 GFH375 进展最快,已启动 III 期临床,其中 HRS-4642 是首个进入 III 期临床的 KRAS G12D 抑制剂。
SHR-1905
7 月 30 日,恒瑞在国内启动一项多中心、随机、双盲、安慰剂对照、平行设计 III 期临床研究,旨在评价 SHR-1905 注射液在重度未控制哮喘患者中的有效性及安全性。
该试验计划入组 408 名受试者,随机分组接受 SHR-1905 注射液、安慰剂治疗。主要研究者是广州医科大学附属第一医院主任医师钟南山和副主任医师杨新艳。
主要终点是哮喘年急性发作率(AAER),次要终点包括第 48 周使用支气管舒张剂前(Pre-BD)第一秒用力呼气容积(FEV1)较基线变化、呼出气一氧化氮(FeNO)较基线变化等。
SHR-1905 为恒瑞自主研发的一款胸腺基质淋巴细胞生成素(TSLP)单克隆抗体,可以阻断炎症细胞因子的释放,抑制下游炎症信号的传导, 最终改善炎症状态并控制疾病进展。
2023 年 8 月,恒瑞与美国 One Bio(后叫 Aiolos Bio)达成协议,将 SHR-1905 注射液项目有偿许可给后者,首付款和近期里程碑付款 2500 万美元,研发和销售里程碑付款不超过 10.25 亿美元。2024 年初,GSK 以 14 亿美元收购 Aiolos Bio 囊获了该产品。
HRS-8080
6 月 17 日,恒瑞在国内启动一项多中心、开放、随机对照的 III 期临床研究,旨在评价 HRS-8080 单药对比医生选择的治疗在既往接受内分泌治疗后出现疾病进展的局部晚期或转移性乳腺癌中的有效性、安全性。
HRS-8080 是恒瑞医药自主研发的一种新型、高效、选择性的口服雌激素受体(ER)降解剂,可强效且高选择性地降解 ER,抑制 ER 活性及下游信号,进而抑制肿瘤细胞增殖,拟用于 ER 阳性及 ER 突变的乳腺癌的治疗。
Insight 数据库显示,全球范围内共有 24 款口服 ER 降解剂在研,卫材的艾拉司群和礼来的 Imlunestrant 已经获批上市。除此之外,还有 7 款已经进入临床 III 期,包括恒瑞、先声、阿斯利康、罗氏、赛诺菲等。
HRS-1893
6 月 15 日,恒瑞医药在国内启动一项多中心、随机、双盲、安慰剂平行对照的 III 期临床试验,旨在评价 HRS-1893 片治疗梗阻性肥厚型心肌病的有效性和安全性,主要终点是治疗第 24 周的临床应答率。
HRS-1893 是恒瑞医药自主研发的 1 类新药,为心肌肌球蛋白(Myosin)选择性可逆抑制剂,可特异性抑制肌球蛋白 ATP 酶的活性,起到抑制心肌过度收缩的作用。
Insight 数据库显示,全球范围内仅有 2 款同靶点药物获批上市,一款为 BMS 的玛伐凯泰,24 年该药的全球销售额达 6.02 亿美元,同比大增超 160%;另一款是 Cytokinetics/赛诺菲在今年获批的阿夫凯泰。国产方面,恒瑞的 HRS-1893 是进展最快的 Myosin 抑制剂。
SHR-A1912
4 月 16 日,恒瑞在国内启动一项随机、开放 III 期临床研究,旨在评价 SHR-A1912 联合利妥昔单抗+吉西他滨+奥沙利铂(R-GemOx)对比 R-GemOx 在复发难治弥漫大 B 细胞淋巴瘤(R/R DLBCL)中的疗效和安全性。
SHR-A1912 是恒瑞自主研发的一款以 CD79b 为靶点的 ADC,可以与表达 CD79b 的肿瘤细胞特异性结合,经肿瘤细胞内吞后在溶酶体内水解释放小分子毒素,从而诱导肿瘤细胞凋亡。2024 年 2 月,SHR-A1912 曾获得美国 FDA 授予快速通道资格,用于治疗既往接受过至少 2 线治疗的 R/R DLBCL。
2025 年 ASCO 会议上,恒瑞公布了 SHR-A1912 联合 R-GemOx 方案治疗 R/R DLBCL 的最新数据。
剂量递增阶段结果显示,1.8 mg/kg 为 SHR-A1912 与 R-GemOx 联合治疗的 RP2D。共有 37 例复发难治 DLBCL 患者接受了 SHR-A1912 1.8 mg/kg 联合 R-GemOx 治疗。其中,62.2% 的受试者对上一线治疗难治,56.8% 的受试者为原发难治。
截至 2025 年 2 月 24 日,37 例复发难治 DLBCL 受试者的中位随访时间为 6.9 个月,中位治疗 9 周期。ORR 为 70.3%,CRR 为 54.1%,6 个月持续缓解率为 95.5%。安全性方面,SHR-A1912 1.8 mg/kg 联合 R-GemOx 整体安全性可耐受。
SHR-2004
2 月 9 日,恒瑞在国内启动 SHR-2004(FXI抑制剂)首个 III 期临床试验(NCT06825416),这是一项多中心、随机、双盲、阳性对照研究,旨在评估全膝关节置换术患者使用 SHR-2004 注射液预防静脉血栓栓塞症(VTE)的有效性和安全性。
SHR-2004 注射液是一种人源化单克隆抗体,可选择性结合凝血因子 FXI 和 FXIa,阻碍 FXIIa 对 FXI 的激活,从而阻断内源性凝血途径的级联反应过程,发挥抗凝作用。临床前研究显示 SHR-2004 延长活化部分凝血活酶时间(APTT),抑制 FXI 活性。
在 2025 年欧洲骨科与创伤学协会(EFORT)大会,恒瑞以口头报告的形式公布了该药在择期单侧全膝关节置换术(TKA)患者中预防 VTE 的 II 期临床研究结果(SHR-2004-201)。
基于mITT 分析集疗法策略分析显示,SHR-2004 60mg SC、120 mg SC、240mg SC、90 mg IV组 vs.对照组首次用药至 D12 的 VTE 和全因死亡复合终点总发生率分别为 21.3% vs. 9.5% vs. 11.1% vs. 3.4% vs. 27.5%,SHR-2004 各组与对照组率差分别为-2.9% vs. -13.0% vs.-14.8% vs. -22.1%。
与对照组相比,SHR-2004 120 mg SC、240 mg SC、90 mg IV组首次用药至治疗期结束(D12)VTE 和全因死亡的发生率更低。
基于安全性分析集(SS),SHR-2004 60 mg SC、120 mg SC、240 mg SC、90 mg IV组 vs. 对照组用药至治疗期结束(D12)期间符合大出血和临床相关的非大出血事件的复合终点发生率分别为 0.0% vs. 1.4% vs. 2.9% vs. 1.6% vs. 4.1%, 且均为临床相关的非大出血事件。此外,SHR-2004 组不良事件发生率与阳性对照组相当,未发现特殊风险信号。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..