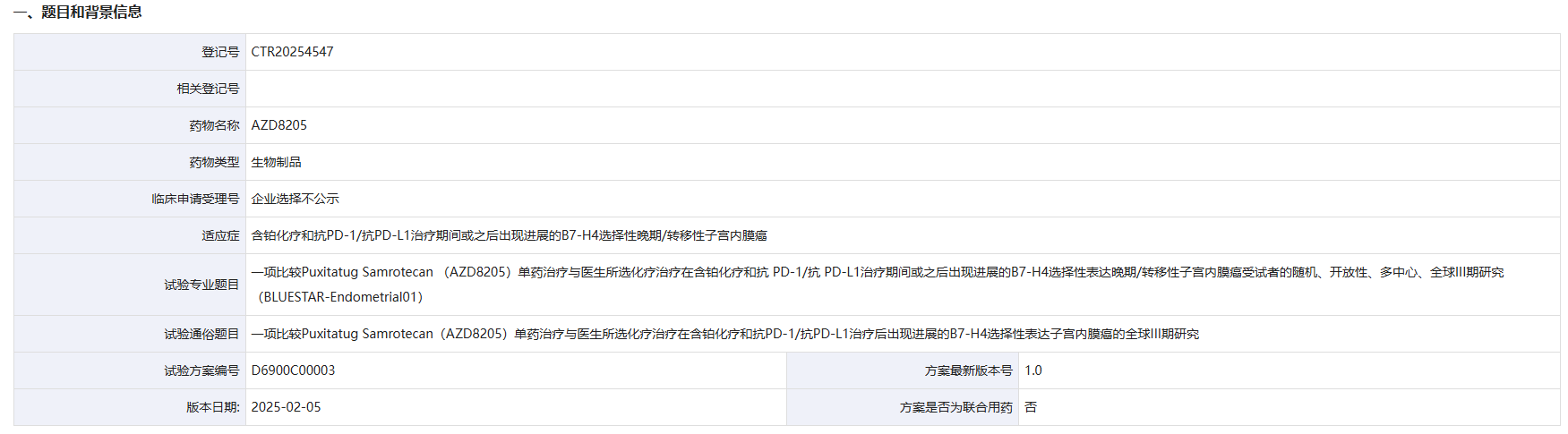
11 月 17 日,药物临床试验登记与信息公示平台官网显示,阿斯利康登记了一项 B7-H4 ADC 新药 Puxitatug Samrotecan(AZD8205)用于 B7-H4 选择性表达子宫内膜癌的全球 III 期研究。
截图来源:临床试验登记与信息公示平台
这是一项随机、开放性、多中心、全球 III 期研究(BLUESTAR-Endometrial01),旨在比较 AZD8205 单药治疗与医生所选化疗治疗在含铂化疗和抗 PD-1/抗 PD-L1治疗期间或之后出现进展的 B7-H4 选择性表达晚期/转移性子宫内膜癌受试者的疗效和安全性。该试验拟在国内入组 105 人,国际入组 700 人,研究的主要终点是 PFS 和 OS。
在 2025 年 SGO 女性癌症年会(SGO Annual Meeting on Women’s Cancer)上,阿斯利康公布了 AZD8205 在 I/IIa 期 BLUESTAR 研究(NCT05276548) 中的最新研究结果。
该研究共纳入 65 名晚期或转移性子宫内膜癌患者。患者被分配到两个剂量队列之一:每 3 周一次 2.0 mg/kg(n = 30)或 2.4 mg/kg(n = 35)。所有入组患者肿瘤均经免疫组织化学证实表达 B7-H4,且所有患者既往没有接受过拓扑异构酶 1 抑制剂治疗。
2.0 mg/kg 队列既往接受治疗方案的中位数为 1.0,2.4 mg/kg 队列为 1.5。大多数患者既往接受过铂类化疗(96.7%;91.4%),相当一部分患者既往接受过 PD-(L)1 抑制剂治疗(63.3%;62.9%)。2.0 mg/kg 队列的 B7-H4 中位表达为 57.5%,2.4 mg/kg 队列为 55.0%。
在疗效方面:
接受 2.0 mg/kg(n = 26)剂量 AZD8205 治疗的可评估患者中,中位随访时间为 4.1 个月,客观缓解率(ORR)为 34.6% ,12 周疾病控制率分别为 80.8%,中位 PFS 为 7.0 个月;
接受 2.4 mg/kg(n = 26)剂量 AZD8205 治疗的可评估患者中,中位随访时间为 4.0 个月,ORR 为 38.5%;12 周疾病控制率为 84.6%,中位 PFS 为 7.0 个月。
在安全性方面,大多数治疗相关不良事件(TRAE)本质上是胃肠道和血液学方面的。此外,2.0 mg/kg 和 2.4 mg/kg 队列中分别有 40.0% 和 34.3% 的患者出现了 3 级或以上的 TRAE。最常见的包括贫血、中性粒细胞减少症、白细胞减少症和腹泻。没有 TRAE 导致治疗中断。
Insight 数据库显示,目前全球在研的处于活跃状态的 B7-H4 ADC 共 10 款,其中 6 个已经进入到临床阶段,分别来自翰森、阿斯利康、映恩生物、LegoChem Biosciences/NextCure、Day One Biopharmaceuticals 和明慧医药。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..