11 月 5 日,CDE 官网显示,第一三共注射用德曲妥珠单抗(DS-8201a,T-DXd,100mg/瓶)的新适应症上市申请获受理,联合帕妥珠单抗用于不可切除或转移性 HER2 阳性成人乳腺癌患者的一线治疗。
这是德曲妥珠单抗在中国提交的第八个适应症的上市申请,也是其在中国申报的第五个乳腺癌适应症的上市申请。
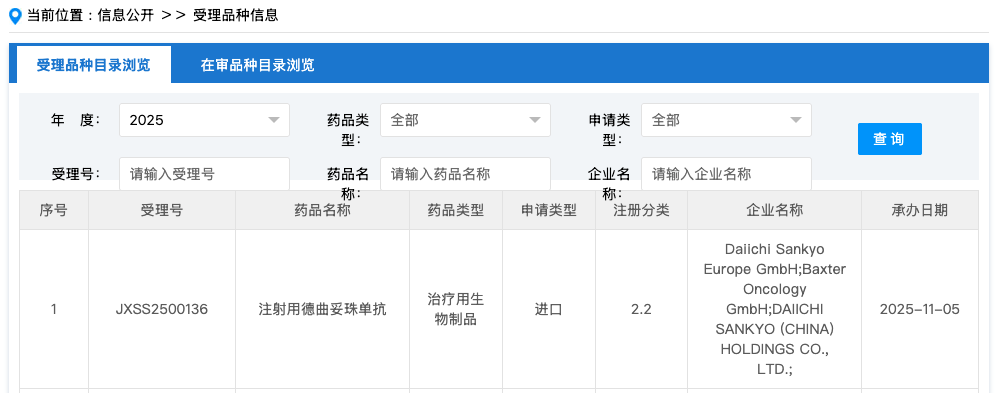
来源:CDE 官网
该上市申请主要基于 DESTINY-Breast09(简称 DB-09)研究的中期分析结果。这是一项评估 T-DXd 联合或不联合帕妥珠单抗(T-DXd 组中对帕妥珠单抗设盲)对比 SoC THP(紫杉烷、曲妥珠单抗和帕妥珠单抗)作为一线药物治疗用于 HER2 阳性、晚期或转移性乳腺癌受试者的疗效和安全性的随机化、三组、全球多中心 III 期研究。主要疗效终点为BICR 评估的 PFS,关键次要疗效终点为 OS。
结果显示,在预设的 PFS 中期分析中,与 THP 组相比,随机分配至 T-DXd 联合帕妥珠单抗组的患者经 BICR 评估的 PFS 显示出统计学显著且具有临床意义的改善。T-DXd 联合帕妥珠单抗组中位 PFS 达 40.7 个月,对比 THP 组为 26.9 个月,疾病进展或死亡风险降低 44%(风险比 0.56,95% 置信区间 [0.44, 0.71];P < 0.00001)。
在各预设的亚组(包括 PIK3CA 突变患者 vs 非突变患者、初发 vs 复发转移性疾病以及激素受体阳性 vs 阴性 HER2 阳性转移性乳腺癌患者)中,均观察到了类似的 PFS 改善。总生存期分析尚不成熟,但观察到改善趋势。同时,观察到的联合治疗组安全性特征与其中各单药治疗的已知安全性特征基本一致,未发现新的安全性信号。
德曲妥珠单抗是一种靶向 HER2 的 ADC,具有与曲妥珠单抗相同的氨基酸序列的人源化抗-HER2 免疫球蛋白 G1(IgG1)单克隆抗体(mAb),通过稳定的基于四肽的连接子与膜通透性拓扑异构酶 I 抑制剂 DXd(依沙替康的衍生物)共价连接,可在肿瘤细胞内被选择性裂解。释放的药物载荷进入细胞核并破坏细胞内的脱氧核糖核酸(DNA),导致细胞死亡。
2019 年 3 月,第一三共与阿斯利康达成了一项 69 亿美元的合作,在全球范围内共同开发和商业化该产品。在国内,德曲妥珠单抗此前已经获批四项适应症(见下图),涵盖乳腺癌、胃癌、非小细胞肺癌。

四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..