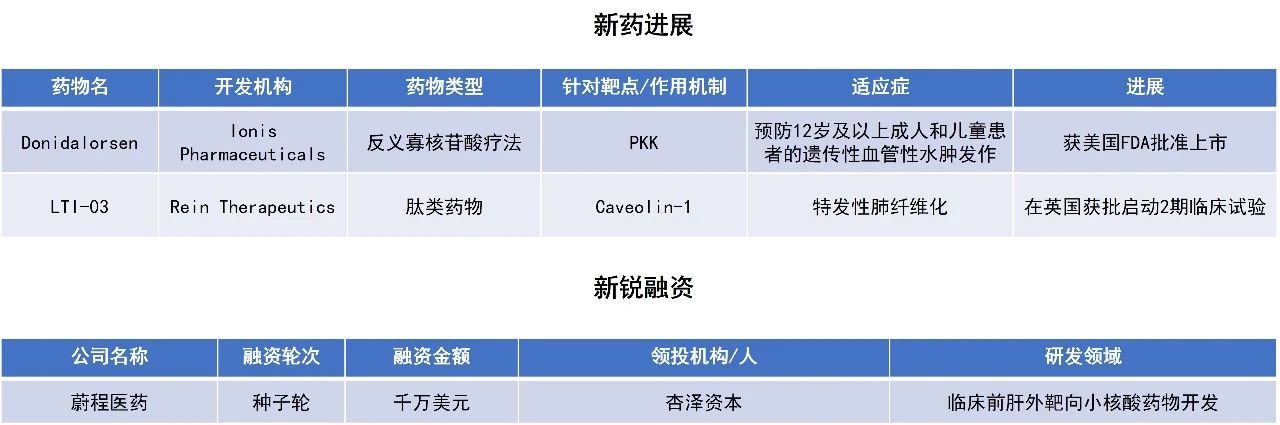
近期,全球多肽和寡核苷酸(TIDES)领域迎来系列进展。Ionis Pharmaceuticals公司的反义寡核苷酸配体偶联(LICA)药物donidalorsen获FDA批准,用于预防遗传性血管性水肿(HAE)发作。蔚程医药完成千万美元种子轮融资,聚焦临床前肝外靶向小核酸平台及管线的开发。本文将节选其中部分重要进展做简单介绍,仅供读者参阅。
Donidalorsen:获美国FDA批准上市
Ionis Pharmaceuticals公司宣布,美国FDA已批准Dawnzera(donidalorsen)用于预防12岁及以上成人和儿童患者的遗传性血管性水肿(HAE)发作。Donidalorsen是一款反义寡核苷酸配体偶联药物,旨在精确靶向以沉默前激肽释放酶(PKK)的表达,中断导致HAE发作的信号通路。PKK在激活与HAE急性发作相关的炎症介质中起重要作用。根据新闻稿,donidalorsen是获批用于HAE的首个RNA靶向药物。
Donidalorsen的批准主要基于全球多中心、随机、双盲、安慰剂对照OASIS-HAE临床3期研究的积极结果。研究达到其主要终点。与安慰剂相比,接受每四周一次(Q4W)donidalorsen皮下注射的患者在24周内月均HAE发作率显著降低81%。当从第二次给药开始评估时,平均发作率降低87%(关键次要终点)。此外,从第二次给药开始测量时,donidalorsen在24周内将中重度HAE发作减少约90%。这些结果得到了进行中的OASISplus开放标签延长期(OLE)研究的进一步支持。在该研究中,随着时间推移,接受每八周一次(Q8W)donidalorsen治疗患者表现出与Q4W相似的疗效。在OLE研究中,两种给药方案均在一年后实现总平均发作率较基线下降94%。
蔚程医药完成千万美元种子轮融资
近日,蔚程医药宣布完成由杏泽资本领投,启明创投跟投的千万美元种子轮融资。本轮募资资金主要用于临床前肝外靶向小核酸平台及管线的开发。该公司成立于2025年,基于自主研发的肝外递送技术平台,主攻小核酸药物在非肝组织的靶向递送,旨在突破传统小核酸药物局限于肝内递送的技术瓶颈,以满足未尽的医疗需求。公司国际化核心团队成员在小核酸领域具多年研发经验,曾主导或深度参与多个肝外靶向核酸药物管线开发,兼具肝外反义寡核苷酸和siRNA管线的开发实践经验。
LTI-03:在英国获批启动2期临床试验
Rein Therapeutics公司宣布,英国药品和保健品监管局(MHRA)已授权公司启动LTI-03的2期RENEW临床试验,针对特发性肺纤维化(IPF)。LTI-03是一种新型的Caveolin-1相关多肽,由7个氨基酸组成,可抑制促纤维化信号传导并帮助关键上皮细胞存活。LTI-03已在美国获得孤儿药资格。此前公布的1b期临床试验结果显示,LTI-03低剂量组患者在接受治疗后,病理性基底样细胞和成纤维细胞中多种促纤维化蛋白的表达降低,与上皮健康相关生物标志物的表达增加。安全性方面,低剂量LTI-03的耐受性良好,未观察到安全信号。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..