7月1日,BioPhorum发布了一份《在受监管的制药环境中实施AI系统》的指南文件,为制药行业在良好生产规范(GxP)环境下应用AI系统提供指导。
随着AI和机器学习(ML)技术在制药行业的广泛应用,药企纷纷接入的同时,AI系统的复杂性和数据驱动特性给传统的计算机系统验证(CSV)带来了新的挑战。目前的监管部门官方文件当中,框架上可供参考的是FDA于1月份发布的《使用人工智能支持药品和生物制品监管决策的考量》,具体实施案例可参考EMA 5月份发布的首个基于AI的创新药物开发方法的认证意见。最新的是刚刚发布的欧盟GMP《附录22:人工智能》指南草案。
非官方文件当中,BioPhorum这份AI指南是继ISPE的GAMP 5第二版附录D11关于AI和ML的内容之后又一重要参考。
指南指出,AI系统与传统计算机系统的主要区别在于其基于数据的学习模式和对训练数据的高度依赖。AI模型的输出是通过训练数据集学习得到的,而非通过明确的编程逻辑。这种特性使得AI系统在数据质量、数据规模、数据漂移(Data Drift)和模型可解释性等方面面临独特的验证挑战。
指南提出了一个AI系统生命周期,包括目的和范围的设定、数据管理与治理、算法选择与模型设计、模型整合与部署、监控与评价以及变更控制等关键阶段。每个阶段都详细列出了需要执行的具体活动和注意事项。指南还将AI生命周期与经典的验证V形图对标。识林翻译如下,供参考(点击放大查阅):
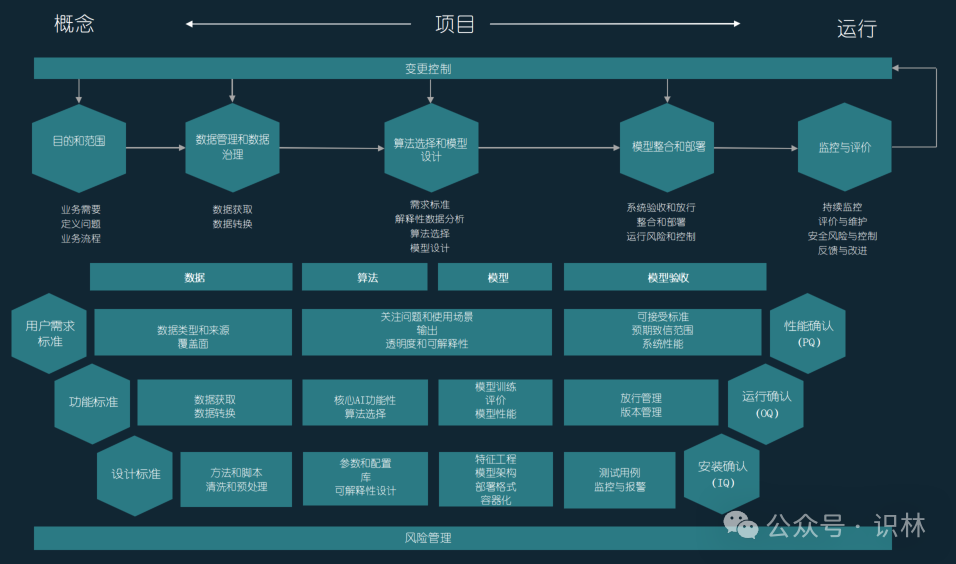
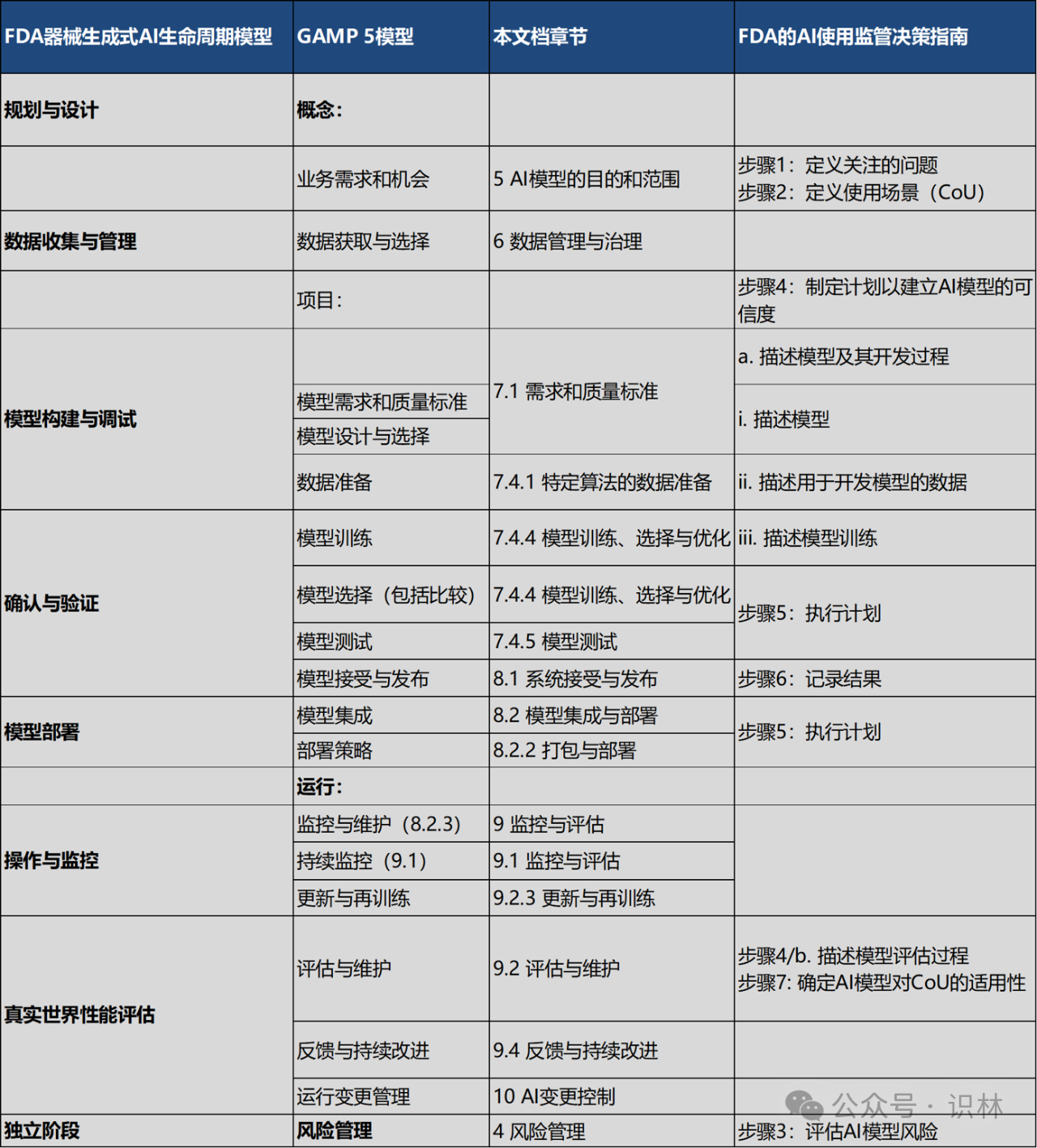
指南还将上述生命周期与FDA指南和GAMP 5提供的模型进行对标,药企可以直观对比当前最前沿的AI监管框架的异同,并创建自有的AI验证流程。下表也已翻译,供参考:
指南文件的另一大特点在于系统性阐述了针对AI系统的变更控制。由于AI不断学习和迭代的特殊性,其变更控制将与传统的监管对象(工艺、仪器、设备等等)迥异。指南描述了变更分类、变更范围识别、变更评估、变更授权、变更执行、变更文档记录以及变更效果监控等步骤。其中,变更分类包括标准变更、正常变更和紧急变更。每种变更类型都有相应的控制程序。对于紧急变更,需要快速响应并确保变更过程符合合规要求。变更文档记录要求详细记录变更的各个方面,包括变更的原因、影响范围、测试结果和最终的批准状态。
在指南末尾的结论部分,BioPhorum 总结了AI技术在制药行业应用的现状与未来发展方向。该部分强调,AI与ML系统因其数据驱动特性、潜在的非确定性行为、复杂架构以及对持续监控的需求,使得在GxP监管框架下的验证工作必须采取定制化的方法。这不仅凸显了AI技术的独特性,也明确了在制药行业应用AI时,不能简单套用传统CSV的模式,而应根据AI系统的特性进行针对性的验证策略制定。
结论部分还提出了未来工作的方向,包括为现有的GxP法规提供针对AI/ML系统的具体应用指导,开发专门的AI验证框架,以及提供关于AI应用风险分类的明确指导等。同时,国际间AI验证标准的协调也将是未来工作的重要方向,这有助于消除跨国制药企业在不同市场应用AI技术时面临的监管差异,促进全球制药行业的创新与发展。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..