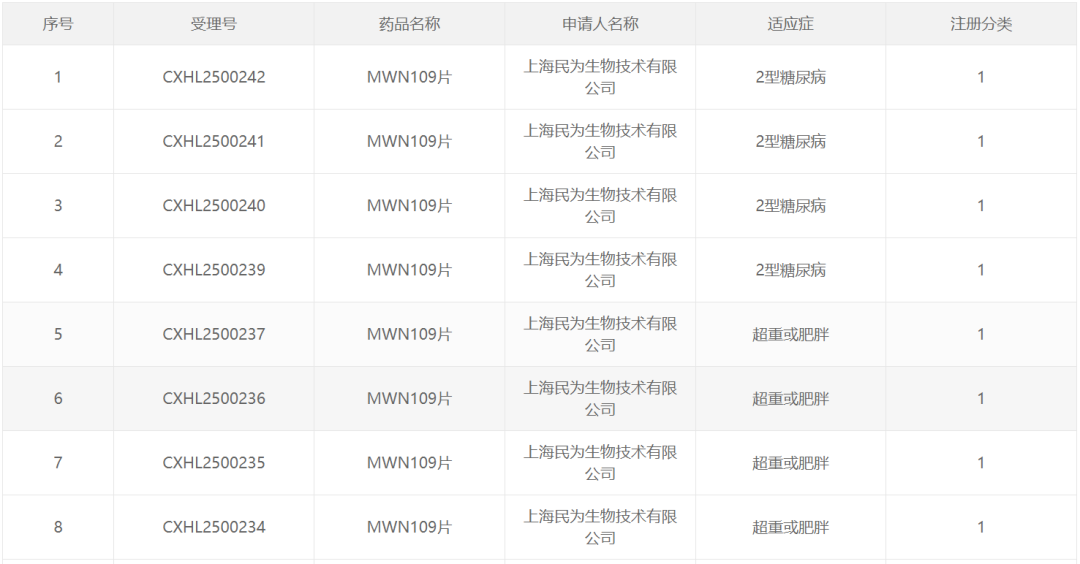
根据乐普医疗公告,MWN109片此次同时获批用于2型糖尿病与减重两大适应症的临床试验,意味着这款创新药物将并行探索代谢疾病的两大核心领域。
MWN109是一款脂肪酸链修饰的GLP-1/GIP/GCG三靶点激动剂,在研发策略上,民为生物同步推进注射液与口服剂型,其中口服剂型为全球首创的GLP-1/GIP/GCG三重激动剂(简称“GGG”)口服药物,具有重要的里程碑意义。
在全球范围,礼来的三靶点产品GIP/GLP-1/GCG三重受体激动剂Retatrutide在临床试验中显示出显著的减重效果,受试者在接受治疗11个月内平均体重减轻可达24%,优于替尔泊肽和司美格鲁肽。此外,该药物还有助于降低糖尿病患者的血糖水平。目前Retatrutide正在进行III期试验中,预计将于2026年完成,预期减重效果达到22–24%,显著优于现有的GLP-1/GIP双靶点替尔泊肽。
GLP-1/GIP/GCG激动剂也被视为下一代代谢药物“新C位”。
面对这一激烈竞逐局面,国际药企纷纷布局:
诺和诺德以高达20亿美元的交易引入联邦制药旗下的GGG候选药物UBT251; 恒瑞医药则将其三靶点产品HRS-4729通过NewCo出海拓展海外市场; 民为生物MWN109注射液处于中美一期临床阶段。凭借中美双报推进注射剂开发,并率先发力口服剂型,布局全球首创的GGG口服版。
结语:
GLP-1类药物正由单点突破走向多靶协同,从注射剂跨越至口服剂型。此次MWN109片获批临床,标志着中国本土企业正逐步缩短与国际巨头的创新差距。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..