4月19日,中国国家药监局药品审评中心(CDE)官网最新公示,渤健(Biogen)申报的诺西那生钠注射液两项新的NDA上市申请获得受理。诺西那生钠(nusinersen)是一款治疗脊髓性肌萎缩症(SMA)的疾病修正治疗药物。该产品此前已经于2019年2月在中国获批治疗5q SMA。5q SMA是该疾病最常见的形式,约占所有SMA病例的95%。
2024年9月,渤健宣布高剂量诺西那生钠临床研究取得积极主要结果,治疗SMA获益显著。与已获批的12毫克剂量方案相比,高剂量治疗方案在临床疗效的关键指标上表现出积极趋势,渤健此前新闻稿表示,计划提交该剂量疗法的上市申请。
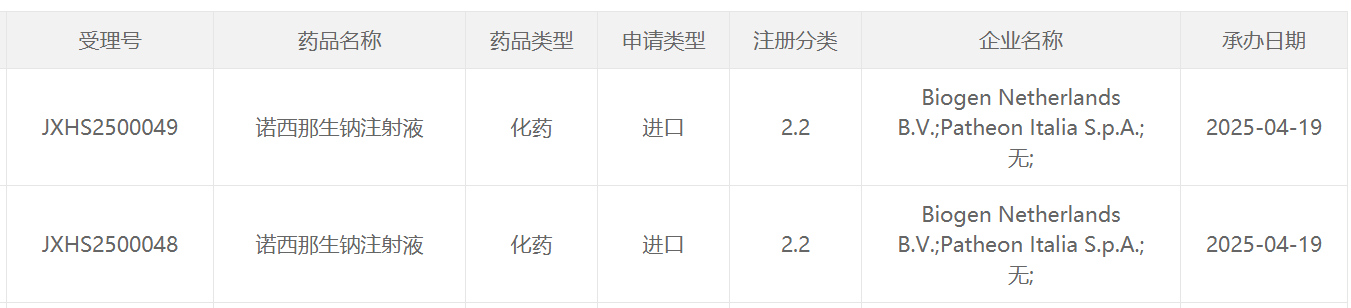
截图来源:CDE官网
SMA是由于运动神经元存活基因1(SMN1)突变导致SMN蛋白功能缺陷所致的遗传性神经肌肉病,以肌无力和肌萎缩为主要临床特征。SMA患者临床表现差异性很大,发病年龄可以从出生前即开始(宫内发病),也可在成年后发病。其中最严重的SMA I型患者在宫内就表现为胎动减少,出生时为松软儿,发病时表现为全身松软无力,严重肌张力低下,最终失去所有自主运动能力,鼻饲喂养、反复呼吸道感染而致呼吸衰竭。
诺西那生钠是一种反义寡核苷酸(ASO),通过鞘内注射直接作用于脊髓运动神经元,可增加完整长度SMN蛋白的产生,从而治疗因SMN1基因(位于染色体5q)突变或缺失造成的SMN蛋白缺乏,进而引起的SMA。2016年底,该药获得美国FDA批准上市脊髓性肌萎缩症,成为首款治疗SMA的疗法。
2024年9月,渤健公布了2/3期DEVOTE研究关键队列(B部分)的积极主要数据。这项研究评估了高剂量诺西那生钠治疗方案对已表现出SMA症状的初治婴儿患者的安全性和疗效。相较已获批的诺西那生钠治疗方案,该在研高剂量治疗方案的初期给药速度更快(两次50毫克,间隔14天),维持剂量更高(每4个月28毫克)。
这项研究在6个月时达到主要终点。相较ENDEAR研究中的预设匹配假手术对照组(初治),接受高剂量方案的婴儿在运动功能方面展现出具有统计学意义的显著改善。
具体而言,DEVOTE研究分为三个部分,共招募了145名不同年龄阶段和不同类型的SMA患者。关键队列B部分由初治SMA婴儿患者(n=75)组成,他们以2:1的比例随机分配接受在研高剂量诺西那生钠治疗方案和已获批的12毫克治疗方案(包括四次初始剂量和每四个月一次的维持剂量)。B部分的主要终点是治疗6个月时费城儿童医院婴儿神经肌肉疾病测试(CHOP-INTEND)结果相对于基线的变化,比较对象为接受高剂量诺西那生钠治疗方案的试验组和3期ENDEAR研究中初治的匹配假手术对照组。ENDEAR是支持诺西那生钠12毫克注射液获得批准的两项关键研究之一。
第64天的数据显示,与已获批的剂量方案相比,高剂量方案显著降低了神经丝水平,表明其能更迅速地减缓神经退行性变。在研究的主要终点上,6个月时CHOP-INTEND量表结果相对于基线的变化表明,高剂量试验组相较匹配假手术对照组取得了具有统计学意义的显著改善。高剂量治疗方案的耐受性总体良好,报告的不良事件与SMA相关症状及诺西那生钠已知的安全性特征基本一致。与12毫克组(72%,18例)相比,高剂量试验组患者发生严重不良事件的比例更低(60%,30例)。
根据中国药物临床试验登记与信息公示平台,DEVOTE研究在中国的部分也已经完成。渤健还正在开展一项国际多中心(含中国)3期临床研究,即在既往参加过诺西那生钠试验性研究的SMA受试者中给予高剂量诺西那生钠的长期扩展研究。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..