2023 年 11 月,国际人用药品注册协调会(ICH)正式发布Q2 (R2)和 Q14 指南,为药品分析程序开发、验证与注册带来了重大变革。3月31日,BioPhorum 团队在深入研究后,发布了一份协会指南《分析方法开发、验证和注册的最佳实践 - 生物制品领域的 ICH Q2 (R2) 和 Q14 的实施》,为行业提供了如何在实践中遵循ICH的详细指导。
这份指南的亮点在于提供了多个表单模板,将ICH指南中的抽象概念转化为实践中可以参考的工具。
分析目标概况(ATP)是ICH新指南中的关键概念。它明确了分析程序的目标,指导技术选择,确保分析程序与生物制品的关键质量属性(CQAs)对齐。BioPhorum强调,ATP 的定义和文档化是分析程序开发的首要任务。通过 ATP,企业能够科学地选择最适合的技术平台,为后续的验证工作奠定基础。
如下图展示的是一个分析程序(ATP)的示例,该程序用于量化单克隆抗体药物(mAb DS)中上游工艺残留物的高效液相色谱(HPLC)程序。

曾广泛用于工艺开发的QbD 原则也是Q14引入到分析方法开发中的。BioPhorum指出,采用系统化、基于风险的方法,能够全面识别分析程序中的关键参数,并制定有效的控制策略。这种科学的开发方式,不仅提高了分析程序的稳健性和可靠性,还为后续的生命周期管理提供了有力支持。
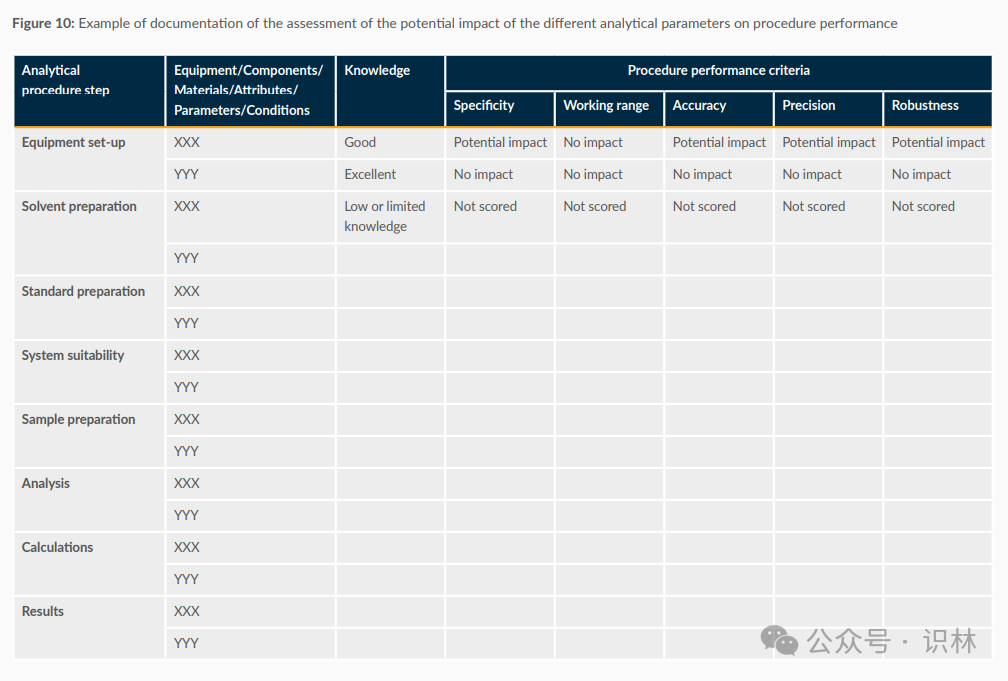
如下图是一个关于分析程序性能评估的示例文档,展示了不同分析参数对程序性能的潜在影响。图中列出了分析程序的各个步骤,包括仪器设置、溶剂准备、标准准备、系统适用性、样品准备、分析、计算和结果。每个步骤都有相应的设备/组件/材料/属性/参数/条件和知识水平的描述。图中还列出了程序性能标准,包括特异性、工作范围、准确性、精确度和稳健性。每个步骤在这些性能标准下的影响被评估为“潜在影响”、“无影响”或“未评分”。
在方法学验证环节,BioPhorum 详细阐述了如何将开发数据有效应用于验证过程,强调了仪器设备确认和 GMP 的重要性。同时,针对生物制品分析程序的特定性能特征,如专属性、灵敏度等,提供了详细的验证指导。此外,还探讨了对现有验证研究的回顾性评估方法,以及 ICH Q2 (R2) 修订版中新增的验证建议。
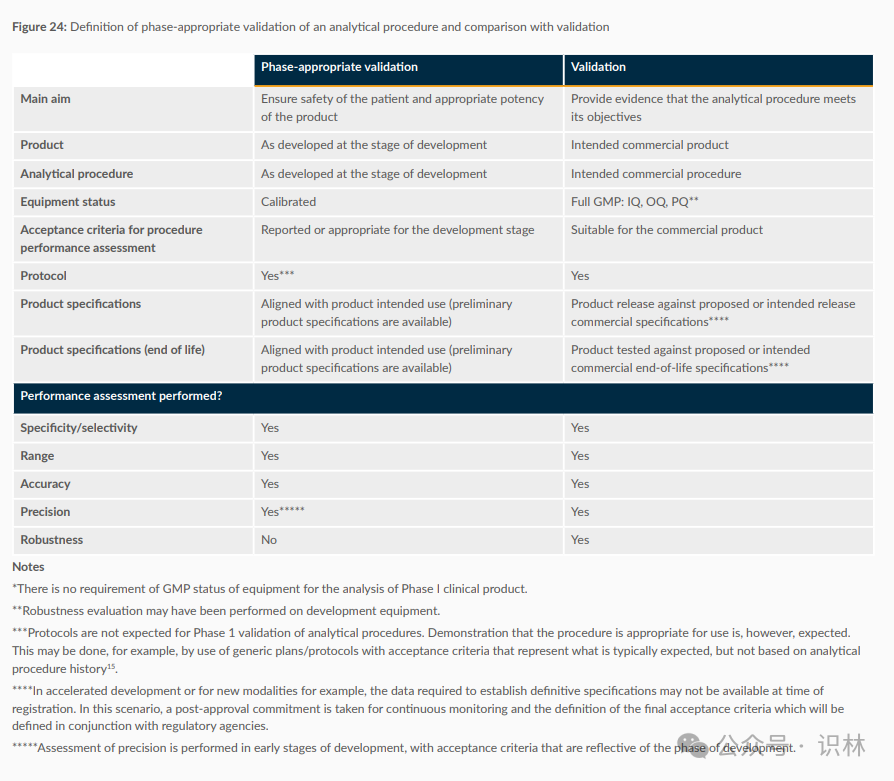
下图展示了分析程序在不同开发阶段的验证要求,以及如何与最终的验证进行比较。图中分为两部分:适应阶段的验证(Phase-appropriate validation)和最终验证(Validation)。
在分析方法的申报和迎检方面,BioPhorum 团队提出企业可创建分析程序生命周期管理(APLCM)文件,以全面记录分析程序从开发到验证,再到变更管理的全过程。这一文件将为监管机构的评估和检查提供清晰、完整的依据,降低监管沟通成本。
下图展示了HPLC/紫外纯度分析程序在两个不同阶段的既定条件(EC)示例,用于实践ICH Q12的上市后变更管理理念。

四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..