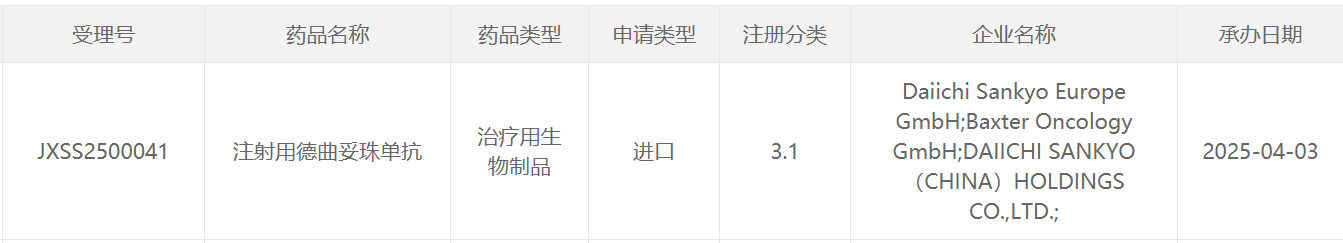
截图来源:CDE官网
在中国,德曲妥珠单抗于2023年2月在中国首次获NMPA批准上市,目前已获批适应症包括:单药治疗既往接受过抗HER2药物治疗的HER2阳性晚期乳腺癌患者;或既往在转移性阶段接受过至少一种系统治疗的,或在辅助化疗期间或完成辅助化疗之后6个月内复发的HER2低表达(IHC 1+或IHC 2+/ISH-)晚期乳腺癌患者以及单药治疗既往接受过两种或两种以上治疗方案的HER2阳性晚期胃或胃食管结合部腺癌患者;治疗存在HER2(ERBB2)激活突变且既往接受过至少一种系统治疗的不可切除的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者。
在全球范围内,德曲妥珠单抗已获批的适应症涵盖HER2阳性([IHC]3+或[ISH]+)乳腺癌;HER2低表达(IHC 1+或IHC 2+/ISH-)乳腺癌;HR阳性、HER2低表达或HER2超低表达乳腺癌;HER2(ERBB2)激活突变非小细胞肺癌;HER2阳性(IHC 3+或IHC 2+/ISH+)胃或GEJ腺癌;HER2阳性(IHC 3+)实体瘤。
根据阿斯利康官网披露的管线信息,基于DESTINY-PanTumor03研究,德曲妥珠单抗治疗HER2表达实体瘤适应症正在中国处于上市申报阶段。DESTINY-PanTumor03是一项2期、多中心、开放标签研究,旨在评估德曲妥珠单抗作为单一疗法或与抗癌药物联合治疗特定HER2表达肿瘤患者的疗效和安全性。根据ClinicalTrials官网,这是一项在中国进行的2期临床研究,在中国32个研究中心开展。
2024年4月,德曲妥珠单抗针对HER2表达实体瘤适适应证获得FDA加速批准。这次批准主要基于在192名经治、不可切除或转移性HER2阳性(IHC 3+)实体瘤成人患者中的疗效评估结果。在DESTINY-PanTumor02中,患者的客观缓解率(ORR)为51.4%,中位DOR为19.4个月。在DESTINY-Lung01中,ORR为52.9%,中位DOR为6.9个月。在DESTINY-CRC02中,ORR为46.9%,DOR为5.5个月。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..